题目内容
18.氢氧化钠是一种重要的化工原料,也是实验室中常见的一种试剂,氢氧化钠必须密封保存,因为易与空气中二氧化碳发生化学反应而变质,用化学方程式表示变质原因2NaOH+CO2═Na2CO3+H2O下面是几位同学对一瓶氢氧化钠固体成分进行的探究
探究一:确定一瓶氢氧化钠固体是否变质
小强方案:
| 实验操作 | 实验现象 | 结论 |
| 取少量样品于试管中,加入一定量水,样品全溶解后,滴加足量的稀盐酸 (填一种溶液) | 有气泡产生 | 氢氧化钠已变质 |
小刚方案:
| 实验操作 | 实验现象 | 结论 |
| ①取少量样品于试管中,加入一定量水后,样品全溶解后,滴加过量的CaCl2溶液 | 产生白色沉淀 | 氢氧化钠固体部分变质 |
| ②静置后取上层清液于试管中,滴入2滴酚酞试液 | 溶液变为红色 |
探究三:定量分析部分变质的氢氧化钠固体中氢氧化钠的含量
下面是小明和小军两位同学不同的设计实验方案
小明实验流程
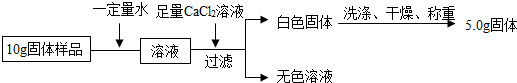
(1)通过小明实验方案计算出样品中氢氧化钠的含量(写出计算过程)
小军实验流程:
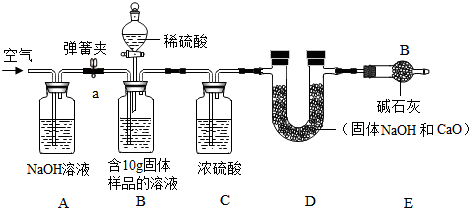
(2)小军实验步骤如下
①检查好装置气密性,装好药品后连接并固定好装置
②打开弹簧夹a,通入一段时间的空气,再称量D装置质量记录为100g
③关闭弹簧夹a,打开B装置中的分液漏斗,滴入稀硫酸,直到瓶内无气泡产生.
④打开弹簧夹a,继续通入一段时间空气,再称量D装置质量记录为102.2g
…
实验分析:(1)在小军实验中A装置作用是吸收生成的CO2.
(2)实验步骤④中,继续通入一段时间空气的目的是为了把所有的二氧化碳都与碱石灰反应.
(3)如果缺少装C,最终所测得氢氧化钠的含量将会偏高(填“偏高”、“不变”、或者“偏低”)
分析 根据氢氧化钠能与空气中的二氧化碳反应,进行分析解答;
探究一:根据碳酸盐遇酸会生成二氧化碳的性质,检验碳酸钠的存在;
探究二:除去碳酸钠,就是把杂质离子转化为沉淀或气体或水而除去;证明氢氧化钠变质时,要考虑碳酸钠的水溶液也显碱性;
方案中滴入过量的CaCl2溶液目的是除去氢氧化钠变质生成的碳酸钠.
探究三:(1)根据白色沉淀碳酸钙的质量求得碳酸钠的质量;
实验分析:
(1)根据A装置作用回答;
(2)把装置内的二氧化碳全部赶出;
(3)由于反应前整个装置中充满空气,空气中有水分和二氧化碳气体,会对实验结果造成影响,去分析解答;依据浓硫酸的吸水性分析判断.
解答 解:氢氧化钠在空气中能与空气中的二氧化碳发生反应生成碳酸钠而变质,反应的化学方程式为:2NaOH+CO2═Na2CO3+H2O;
探究一:碳酸盐可以与酸反应放出能使澄清石灰水变浑浊的二氧化碳气体;所以无色溶液可能是盐酸;
探究二:氯化钡溶液与碳酸钠溶液反应生成碳酸钡沉淀和氯化钠,所以根据题中的实验结论可以知道能观察到的现象为:有白色沉淀生成,有关反应的化学方程式为:Na2CO3+BaCl2=BaCO3↓+2NaCl,而氯化钠、氯化钡溶液都呈中性;故在反应后的溶液中滴入酚酞,溶液变红色,则一定是氢氧化钠溶液使酚酞变红,所以氢氧化钠没有完全变质;小刚实验方案中滴入过量的CaCl2溶液目的除去氢氧化钠变质生成的碳酸钠.
(1)碳酸钙的质量为5g,设碳酸钠的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 5g
$\frac{106}{x}=\frac{100}{5g}$
x=5.3g
所以样品中氢氧化钠的含量$\frac{5.3g}{10g}$×100%=53%;
(1)由浓硫酸的吸水性可知B装置的作用是:干燥CO2气体吸收生成的CO2;因为氢氧化钠溶液可与二氧化碳反应生成碳酸钠和水,所以该装置的作用是吸收生成的CO2;
(2)由于反应前整个装置中充满空气,空气中有水分和二氧化碳气体,会对实验结果造成影响,把以要在步骤②中在A处通入一段时间空气的以便除去整个装置的二氧化碳气体;
(3)前面没有C装置吸收水分,因为碱石灰的物质组成是氢氧化钠和生石灰,两者可吸收水与二氧化碳,从而吸收空气中的H2O和CO2防止C装置测量的数据不准确,计算得到的氢氧化钠质量分数比实际值偏高,说明该装置吸收的二氧化碳量较小,计算式会导致计算的碳酸钠质量变小,氢氧化钠质量偏大,因此可能的原因是:生成的CO2没有被C装置完全吸收;
故答案为:2NaOH+CO2═Na2CO3+H2O;
探究一:稀盐酸 氢氧化钠钠已变质
探究二:溶液变红;除去氢氧化钠变质生成的碳酸钠
探究三:
(1)碳酸钙的质量为5g,设碳酸钠的质量为x
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100
x 5g
$\frac{106}{x}=\frac{100}{5g}$
x=5.3g
所以样品中氢氧化钠的含量$\frac{5.3g}{10g}$×100%=53%;
实验分析:(1)吸收生成的CO2;(2)除去装置中的二氧化碳气体;(3)偏高
点评 本题综合考查了氢氧化钠的性质以及碳酸根的检验方法及除杂方法,注意把握加入试剂的量,除杂过程中不能加入新的杂质离子,正确选择试剂.

| 实验次数 | 1 | 2 | 3 | 4 |
| 固体混合物的质量(g) | 20 | 20 | 20 | 20 |
| 加入NaOH溶液的质量(g) | 20 | 40 | 60 | 80 |
| 生成沉淀的质量(g) | 4.9 | m | 10.5 | 10.5 |
(1)表中m的值为9.8g;
(2)原固体混合物中硫酸铜的质量分数是多少?(精确到0.1%)
| A. | 干燥的药品可以直接放在托盘天平上称量质量 | |
| B. | 向容器中装药品时,应先装液体药品,再装固体药品 | |
| C. | 加热烧杯、试管中的液体时,需用酒精灯隔着石棉网加热 | |
| D. | 收集有氧气的集气瓶,应盖着毛玻璃片,正放在实验桌上 |
| A. | 进入矿井前做灯火实验 | |
| B. | 夜晚发现家用燃气泄漏需开灯检查 | |
| C. | 为了勤俭节约,可以食用霉变不严重的大米 | |
| D. | 浓硫酸滴在皮肤和衣物应先用大量水冲洗 |
| 温度 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | |
| 溶解度 | NaCl | 35.7g | 36.0g | 36.6g | 37.3g | 38.4g |
| KNO3 | 13.3g | 31.6g | 63.9g | 110g | 169g | |
(2)60℃时,把113.3g KNO3和20g NaCl全部放入100g水中,充分溶解后形成KNO3和NaCl的不饱和溶液(填“饱和溶液”或“不饱和溶液”),降温至0℃时,溶液中NaCl的质量是20g,析出KNO3的质量是96.7g.由此得出从KNO3和NaCl的混合溶液中KNO3提纯的方法是降温结晶.
| A. | H2SO4 Na2O MgCl2 C CO | B. | Mg(OH)2 CuSO4 CaO C CO2 | ||
| C. | MgSO4 KOH NaCl O2 SO3 | D. | HCl NaOH NH4Cl O2 P2O5 |
| A. | NaOH、CuSO4、H2SO4 | B. | NaCl、Na2SO4、NaOH | ||
| C. | NaCl、Ba(NO3)2、HCl | D. | NH4NO3、NaOH、Na2SO4 |
 由如图中硝酸钾和氯化钠两种物质的溶解度曲线回答:
由如图中硝酸钾和氯化钠两种物质的溶解度曲线回答: