题目内容
10.如表是氯化钠和硝酸钾在不同温度时的溶解度:| 温度 | 0℃ | 20℃ | 40℃ | 60℃ | 80℃ | |
| 溶解度 | NaCl | 35.7g | 36.0g | 36.6g | 37.3g | 38.4g |
| KNO3 | 13.3g | 31.6g | 63.9g | 110g | 169g | |
(2)60℃时,把113.3g KNO3和20g NaCl全部放入100g水中,充分溶解后形成KNO3和NaCl的不饱和溶液(填“饱和溶液”或“不饱和溶液”),降温至0℃时,溶液中NaCl的质量是20g,析出KNO3的质量是96.7g.由此得出从KNO3和NaCl的混合溶液中KNO3提纯的方法是降温结晶.
分析 (1)根据表中数据可知影响物质溶解度的因素有温度、溶质的种类;
(2)根据溶解度的意义计算、分析判断.
解答 解:(1)根据表中数据可以看出:NaCl的溶解度受温度的变化影响不大,KNO3的溶解度受温度的变化影响较大等;
(2)由于在60℃时,KNO3的溶解度是110g,NaCl的溶解度是37.3g,在0℃时,KNO3的溶解度是13.3g,NaCl的溶解度是35.7g所以,60℃时,把113.3g KNO3和20g NaCl全部放入100g水中,充分溶解后形成KNO3和NaCl的不饱和溶液,降温至0℃时,溶液中NaCl的质量是20g,析出KNO3的质量是110 g-13.3g=96.7g.由此得出从KNO3和NaCl的混合溶液中KNO3提纯的方法是降温结晶.
故答为:(1)NaCl的溶解度受温度的变化影响不大等;(2)不饱和溶液,20,96.7,降温结晶.
点评 此题是溶解度知识的具体应用,对学生深入理解溶解度的概念有一定帮助,同时也复习了有关混合物分离的一些常识性的基础知识.

练习册系列答案
相关题目
1. 许多物质在溶液中都有离子形式存在,我们熟悉的复分解反应就是溶液中离子间结合得到水、气体或沉淀的一类化学反应.如:氢氧化钠与盐酸的反应就是溶液中的H+和OH-结合成水分子的过程(如图所示).结合信息、图示,你认为下列各组离子间不能反应的是( )
许多物质在溶液中都有离子形式存在,我们熟悉的复分解反应就是溶液中离子间结合得到水、气体或沉淀的一类化学反应.如:氢氧化钠与盐酸的反应就是溶液中的H+和OH-结合成水分子的过程(如图所示).结合信息、图示,你认为下列各组离子间不能反应的是( )
 许多物质在溶液中都有离子形式存在,我们熟悉的复分解反应就是溶液中离子间结合得到水、气体或沉淀的一类化学反应.如:氢氧化钠与盐酸的反应就是溶液中的H+和OH-结合成水分子的过程(如图所示).结合信息、图示,你认为下列各组离子间不能反应的是( )
许多物质在溶液中都有离子形式存在,我们熟悉的复分解反应就是溶液中离子间结合得到水、气体或沉淀的一类化学反应.如:氢氧化钠与盐酸的反应就是溶液中的H+和OH-结合成水分子的过程(如图所示).结合信息、图示,你认为下列各组离子间不能反应的是( )| A. | H+ Na+ 0H-NO3- | B. | H+ K+CO32- HCO3- | ||
| C. | K+ Ba2+ Cl- SO42- | D. | Na+ K+Cl-OH- |
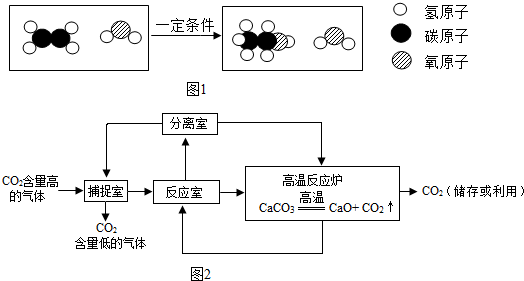
18.氢氧化钠是一种重要的化工原料,也是实验室中常见的一种试剂,氢氧化钠必须密封保存,因为易与空气中二氧化碳发生化学反应而变质,用化学方程式表示变质原因2NaOH+CO2═Na2CO3+H2O
下面是几位同学对一瓶氢氧化钠固体成分进行的探究
探究一:确定一瓶氢氧化钠固体是否变质
小强方案:
探究二:确定氢氧化钠固体变质的程度
小刚方案:
小刚实验方案中滴入过量的CaCl2溶液目的是除去氢氧化钠变质生成的碳酸钠.
探究三:定量分析部分变质的氢氧化钠固体中氢氧化钠的含量
下面是小明和小军两位同学不同的设计实验方案
小明实验流程
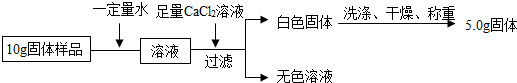
(1)通过小明实验方案计算出样品中氢氧化钠的含量(写出计算过程)
小军实验流程:
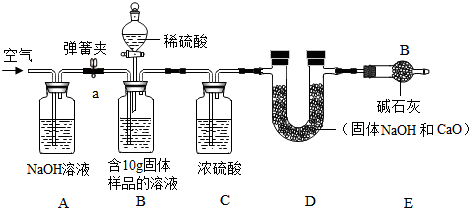
(2)小军实验步骤如下
①检查好装置气密性,装好药品后连接并固定好装置
②打开弹簧夹a,通入一段时间的空气,再称量D装置质量记录为100g
③关闭弹簧夹a,打开B装置中的分液漏斗,滴入稀硫酸,直到瓶内无气泡产生.
④打开弹簧夹a,继续通入一段时间空气,再称量D装置质量记录为102.2g
…
实验分析:(1)在小军实验中A装置作用是吸收生成的CO2.
(2)实验步骤④中,继续通入一段时间空气的目的是为了把所有的二氧化碳都与碱石灰反应.
(3)如果缺少装C,最终所测得氢氧化钠的含量将会偏高(填“偏高”、“不变”、或者“偏低”)
下面是几位同学对一瓶氢氧化钠固体成分进行的探究
探究一:确定一瓶氢氧化钠固体是否变质
小强方案:
| 实验操作 | 实验现象 | 结论 |
| 取少量样品于试管中,加入一定量水,样品全溶解后,滴加足量的稀盐酸 (填一种溶液) | 有气泡产生 | 氢氧化钠已变质 |
小刚方案:
| 实验操作 | 实验现象 | 结论 |
| ①取少量样品于试管中,加入一定量水后,样品全溶解后,滴加过量的CaCl2溶液 | 产生白色沉淀 | 氢氧化钠固体部分变质 |
| ②静置后取上层清液于试管中,滴入2滴酚酞试液 | 溶液变为红色 |
探究三:定量分析部分变质的氢氧化钠固体中氢氧化钠的含量
下面是小明和小军两位同学不同的设计实验方案
小明实验流程

(1)通过小明实验方案计算出样品中氢氧化钠的含量(写出计算过程)
小军实验流程:

(2)小军实验步骤如下
①检查好装置气密性,装好药品后连接并固定好装置
②打开弹簧夹a,通入一段时间的空气,再称量D装置质量记录为100g
③关闭弹簧夹a,打开B装置中的分液漏斗,滴入稀硫酸,直到瓶内无气泡产生.
④打开弹簧夹a,继续通入一段时间空气,再称量D装置质量记录为102.2g
…
实验分析:(1)在小军实验中A装置作用是吸收生成的CO2.
(2)实验步骤④中,继续通入一段时间空气的目的是为了把所有的二氧化碳都与碱石灰反应.
(3)如果缺少装C,最终所测得氢氧化钠的含量将会偏高(填“偏高”、“不变”、或者“偏低”)
5.下列除去杂质的试剂或方法正确的是( )
| 选项 | 括号中为杂质 | 除杂试剂或方法 |
| A | 氢氧化钠溶液(碳酸钠) | 氯化钙溶液 |
| B | 二氧化碳(氯化氢) | 氢氧化钠溶液 |
| C | 碳酸亚铁溶液(碳酸铜) | 锌 |
| D | 氧化钙(碳酸钙) | 高温煅烧 |
| A. | A | B. | B | C. | C | D. | D |
15.下列有关物质的检验、除杂质所用的试剂或方法错误的是( )
| A. | 检验NH4Cl溶液和Na2SO4溶液;所用试剂或方法:NaOH溶液或Ba(OH)2溶液 | |
| B. | 区分失去标签的白酒和白醋:所用试剂或方法:闻气味 | |
| C. | 除去生石灰中含有的杂质石灰石:所用试剂或方法:水或稀盐酸 | |
| D. | 除去NaCl溶液中含有的少量Na2CO3:所用试剂或方法:稀盐酸 |
19.近年来,一些国家正在试用碳酸水浇灌某些植物,其主要作用除了改良碱性土壤外,还能( )
| A. | 促进植物的呼吸作用 | B. | 加速植物的光合作用 | ||
| C. | 增加植物生长所需的微量元素 | D. | 代替碳铵等作氮肥使用 |
20.下列实验现象和对应的结论描述正确的是( )
| A. | 向某物质中加入酸溶液,有气泡产生---一定是碳酸根 | |
| B. | 向某溶液里滴加硝酸银溶液,有白色沉淀---一定是盐酸盐溶液 | |
| C. | 向某溶液中加入氯化钡溶液,有白色沉淀---一定是硫酸盐溶液 | |
| D. | 某金属片伸入硫酸铜溶液,溶液变成浅绿色---一定是铁 |