题目内容
13.用化学符号填空①氮元素N ②两个氧气分子2O2 ③氯离子Cl-
④二氧化硫中硫元素的化合价$\stackrel{+4}{S}$O2 ⑤甲烷燃烧的化学方程式CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.
分析 ①书写元素符号时应注意:①有一个字母表示的元素符号要大写;②由两个字母表示的元素符号,第一个字母大写,第二个字母小写.
②分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字.
③离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.
④化合价的表示方法,在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后.
⑤甲烷在点燃条件下燃烧生成二氧化碳和水,写出反应的化学方程式即可.
解答 解:①氮元素的元素符号为:N.
②由分子的表示方法,正确书写物质的化学式,表示多个该分子,就在其化学式前加上相应的数字,则两个氧气分子可表示为:2O2.
③由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.故氯离子可表示为:Cl-.
④二氧化硫中氧元素显-2价,硫元素的化合价为+4价;由化合价的表示方法,在其化学式该元素的上方用正负号和数字表示,正负号在前,数字在后,故二氧化硫中硫元素的化合价可表示为:$\stackrel{+4}{S}$O2.
⑤甲烷在点燃条件下燃烧生成二氧化碳和水,反应的化学方程式为CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.
故答案为:①N;②2O2;③Cl-;④$\stackrel{+4}{S}$O2;⑤CH4+2O2$\frac{\underline{\;点燃\;}}{\;}$CO2+2H2O.
点评 本题难度不大,掌握常见化学用语(元素符号、分子符号、化化学方程式、化合价、离子符号等)的书写方法、离子符号与化合价表示方法的区别等是正确解答此类题的关键.

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案 许多物质在溶液中都有离子形式存在,我们熟悉的复分解反应就是溶液中离子间结合得到水、气体或沉淀的一类化学反应.如:氢氧化钠与盐酸的反应就是溶液中的H+和OH-结合成水分子的过程(如图所示).结合信息、图示,你认为下列各组离子间不能反应的是( )
许多物质在溶液中都有离子形式存在,我们熟悉的复分解反应就是溶液中离子间结合得到水、气体或沉淀的一类化学反应.如:氢氧化钠与盐酸的反应就是溶液中的H+和OH-结合成水分子的过程(如图所示).结合信息、图示,你认为下列各组离子间不能反应的是( )| A. | H+ Na+ 0H-NO3- | B. | H+ K+CO32- HCO3- | ||
| C. | K+ Ba2+ Cl- SO42- | D. | Na+ K+Cl-OH- |
| A. | 高锰酸钾属于氧化物 | |
| B. | 高锰酸钾中各种元素的质量比为1:1:4 | |
| C. | 高锰酸钾中氧元素的质量分数为40.51% | |
| D. | 高锰酸根离子的符号为MnO${\;}_{4}^{2-}$ |
下面是几位同学对一瓶氢氧化钠固体成分进行的探究
探究一:确定一瓶氢氧化钠固体是否变质
小强方案:
| 实验操作 | 实验现象 | 结论 |
| 取少量样品于试管中,加入一定量水,样品全溶解后,滴加足量的稀盐酸 (填一种溶液) | 有气泡产生 | 氢氧化钠已变质 |
小刚方案:
| 实验操作 | 实验现象 | 结论 |
| ①取少量样品于试管中,加入一定量水后,样品全溶解后,滴加过量的CaCl2溶液 | 产生白色沉淀 | 氢氧化钠固体部分变质 |
| ②静置后取上层清液于试管中,滴入2滴酚酞试液 | 溶液变为红色 |
探究三:定量分析部分变质的氢氧化钠固体中氢氧化钠的含量
下面是小明和小军两位同学不同的设计实验方案
小明实验流程
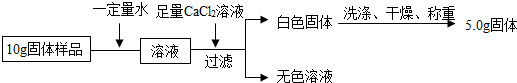
(1)通过小明实验方案计算出样品中氢氧化钠的含量(写出计算过程)
小军实验流程:
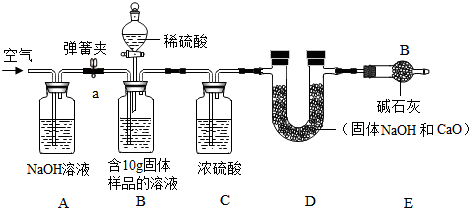
(2)小军实验步骤如下
①检查好装置气密性,装好药品后连接并固定好装置
②打开弹簧夹a,通入一段时间的空气,再称量D装置质量记录为100g
③关闭弹簧夹a,打开B装置中的分液漏斗,滴入稀硫酸,直到瓶内无气泡产生.
④打开弹簧夹a,继续通入一段时间空气,再称量D装置质量记录为102.2g
…
实验分析:(1)在小军实验中A装置作用是吸收生成的CO2.
(2)实验步骤④中,继续通入一段时间空气的目的是为了把所有的二氧化碳都与碱石灰反应.
(3)如果缺少装C,最终所测得氢氧化钠的含量将会偏高(填“偏高”、“不变”、或者“偏低”)
| 选项 | 括号中为杂质 | 除杂试剂或方法 |
| A | 氢氧化钠溶液(碳酸钠) | 氯化钙溶液 |
| B | 二氧化碳(氯化氢) | 氢氧化钠溶液 |
| C | 碳酸亚铁溶液(碳酸铜) | 锌 |
| D | 氧化钙(碳酸钙) | 高温煅烧 |
| A. | A | B. | B | C. | C | D. | D |
【提出问题1】该样品中含有哪些物质?
【提出猜想】通过分析,提出如下猜想:
猜想Ⅰ:已完全变质,该样品中只含Na2CO3;
猜想Ⅱ:部分变质,该样品中含有NaOH和Na2CO3.
(1)则NaOH变质反应的化学方程式为CO2+2NaOH=Na2CO3+H2O.
【查阅资料】
①碱性的Na2CO3溶液可以与中性的CaCl2溶液发生复分解反应.
②二氧化碳在饱和的碳酸氢钠溶液中几乎不溶解,在27℃、101kPa时的密度为A1.8g•L-1.
【实验探究1】
(2)为确定该样品的成分,小明设计了如下实验方案,请你一起完成下列实验报告.
| 实验操作 | 实验现象 | 实验结论 |
| (a)取少量样品溶于水,加入 过量的氯化钙溶液; | 有白色沉淀产生 | 该反应的化学方程式为 Na2CO3+CaCl2═CaCO3↓+2NaCl |
| (b)静置,向将上述反应后的混合液过滤,取滤液加入酚酞试液. | 溶液变红色 | 证明猜想Ⅱ成立 |
【实验探究2】
小红同学设计了如图所示的装置(铁架台略去),在27℃、101kPa下按下列步骤进行实验:

①按图连接好装置;
②用托盘天平准确称取该样品2g,放入A中试管内,向B中集气瓶中倒入X溶液至瓶颈处;
③向分液漏斗中加入稀硫酸,打开活塞,让稀硫酸滴入试管中至过量,关闭活塞.反应结束后,量筒中收集到X溶液220mL.
(3)在实验步骤①和②之间,还缺少一实验步骤,该实验步骤是检查装置的气密性.
(4)B中集气瓶盛装的X溶液应为避免二氧化碳溶解在水里而损耗,造成测定结果偏低溶液.
(5)试管中原有的空气对实验结果没有(选填“有”或“没有”)明显影响.
(6)变质氢氧化钠样品中碳酸钠的质量分数为48%(精确至1%).
【提出问题3】怎样提纯该样品得到较纯净的氢氧化钠固体?
【实验探究3】
为了得到较纯净的氢氧化钠固体,小亮明设计了如图所示的实验流程.
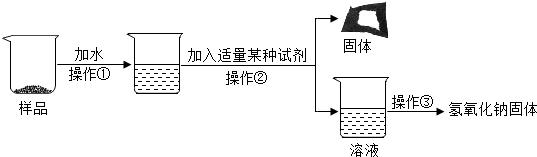
(7)操作②的名称是溶解、过滤、蒸发;,为了使样品充分溶解,操作①中还要用到的玻璃仪器是玻璃棒.
(8)该实验中发生反应的化学方程式为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH.
(9)最终所得氢氧化钠固体的质量大于变质样品中氢氧化钠的质量(选填“大于”、“等于”或“小于”).
【反思与交流】
(10)敞口放置的氢氧化钠溶液容易变质,所以试剂瓶要用橡皮塞密封保存.
(11)通过本题,你学会了定性检验氢氧化钠的变质、定量测定变质后某成分的含量,以及除杂提纯物质.为了得到可靠的实验结果,探究过程中你需要思考问题有
①②④⑤⑥(填数字序号);
①选择试剂种类 ②确定试剂用量 ③试剂产地
④实验装置与步骤的设计 ⑤实验安全环保 ⑥测量中减少误差
(12)【实验探究1】中的检验和【实验探究3】中的除杂都将碳酸钠进行了转化,但二者目的不同,它们分别是检验中将碳酸钠转化为氯化钠,以排除对氢氧化钠检验的干扰;除杂中是将碳酸钠转化为产品氢氧化钠.
 生活中处处有化学.
生活中处处有化学.