题目内容
8. 由如图中硝酸钾和氯化钠两种物质的溶解度曲线回答:
由如图中硝酸钾和氯化钠两种物质的溶解度曲线回答:(1)在t1℃时,硝酸钾的溶解度约为20 g.
(2)溶解度受温度影响较小的物质是氯化钠,要从该物质的溶液中结晶析出宜采用的方法是蒸发.
(3)A点的意义在t2℃时硝酸钾和氯化钠的溶解度相等
(4)将20℃时饱和硝酸钾溶液升温到30℃,则所得溶液是不饱和溶液(选填“饱和溶液”或“不饱和溶液”)
分析 根据已有的溶解度曲线的意义进行分析解答,交点表示在该温度下二者的溶解度相等,根据溶解度曲线可以判断物质的溶解度的大小,硝酸钾的溶解度随温度的升高而增大,据此解答.
解答 解:(1)据图可以看出,在t1℃时,硝酸钾的溶解度约为20g,故填:20.
(2)据图可以看出,溶解度受温度影响较小的物质是氯化钠,要从该物质的溶液中结晶析出宜采用的方法是蒸发,故填:氯化钠,蒸发.
(3)A点表示在t2℃时硝酸钾和氯化钠的溶解度相等,故填:在t2℃时硝酸钾和氯化钠的溶解度相等;
(4)将20℃时饱和硝酸钾溶液升温到30℃,硝酸钾的溶解度增大,故则所得溶液是不饱和溶液,故填:不饱和溶液.
点评 本题考查的是溶解度曲线的应用,完成此题,可以依据已有的溶解度曲线的意义进行.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
13.下列鉴别物质的试剂,不正确的是( )
| 序号 | 待鉴别的物质 | 鉴别试剂 |
| A | 蒸馏水与过氧化氢溶液 | 二氧化锰 |
| B | 硝酸铵与食盐固体 | 水 |
| C | 稀盐酸与氯化钠溶液 | 酚酞溶液 |
| D | 一氧化碳与二氧化碳气体 | 澄清的石灰水 |
| A. | A | B. | B | C. | C | D. | D |
17.下列物质中属于纯净物的是( )
| A. | 自来水 | B. | 水银 | C. | 白酒 | D. | 雪碧饮料 |
18.氢氧化钠是一种重要的化工原料,也是实验室中常见的一种试剂,氢氧化钠必须密封保存,因为易与空气中二氧化碳发生化学反应而变质,用化学方程式表示变质原因2NaOH+CO2═Na2CO3+H2O
下面是几位同学对一瓶氢氧化钠固体成分进行的探究
探究一:确定一瓶氢氧化钠固体是否变质
小强方案:
探究二:确定氢氧化钠固体变质的程度
小刚方案:
小刚实验方案中滴入过量的CaCl2溶液目的是除去氢氧化钠变质生成的碳酸钠.
探究三:定量分析部分变质的氢氧化钠固体中氢氧化钠的含量
下面是小明和小军两位同学不同的设计实验方案
小明实验流程
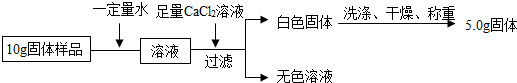
(1)通过小明实验方案计算出样品中氢氧化钠的含量(写出计算过程)
小军实验流程:
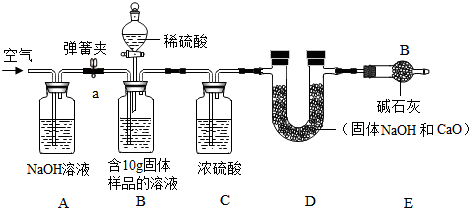
(2)小军实验步骤如下
①检查好装置气密性,装好药品后连接并固定好装置
②打开弹簧夹a,通入一段时间的空气,再称量D装置质量记录为100g
③关闭弹簧夹a,打开B装置中的分液漏斗,滴入稀硫酸,直到瓶内无气泡产生.
④打开弹簧夹a,继续通入一段时间空气,再称量D装置质量记录为102.2g
…
实验分析:(1)在小军实验中A装置作用是吸收生成的CO2.
(2)实验步骤④中,继续通入一段时间空气的目的是为了把所有的二氧化碳都与碱石灰反应.
(3)如果缺少装C,最终所测得氢氧化钠的含量将会偏高(填“偏高”、“不变”、或者“偏低”)
下面是几位同学对一瓶氢氧化钠固体成分进行的探究
探究一:确定一瓶氢氧化钠固体是否变质
小强方案:
| 实验操作 | 实验现象 | 结论 |
| 取少量样品于试管中,加入一定量水,样品全溶解后,滴加足量的稀盐酸 (填一种溶液) | 有气泡产生 | 氢氧化钠已变质 |
小刚方案:
| 实验操作 | 实验现象 | 结论 |
| ①取少量样品于试管中,加入一定量水后,样品全溶解后,滴加过量的CaCl2溶液 | 产生白色沉淀 | 氢氧化钠固体部分变质 |
| ②静置后取上层清液于试管中,滴入2滴酚酞试液 | 溶液变为红色 |
探究三:定量分析部分变质的氢氧化钠固体中氢氧化钠的含量
下面是小明和小军两位同学不同的设计实验方案
小明实验流程

(1)通过小明实验方案计算出样品中氢氧化钠的含量(写出计算过程)
小军实验流程:

(2)小军实验步骤如下
①检查好装置气密性,装好药品后连接并固定好装置
②打开弹簧夹a,通入一段时间的空气,再称量D装置质量记录为100g
③关闭弹簧夹a,打开B装置中的分液漏斗,滴入稀硫酸,直到瓶内无气泡产生.
④打开弹簧夹a,继续通入一段时间空气,再称量D装置质量记录为102.2g
…
实验分析:(1)在小军实验中A装置作用是吸收生成的CO2.
(2)实验步骤④中,继续通入一段时间空气的目的是为了把所有的二氧化碳都与碱石灰反应.
(3)如果缺少装C,最终所测得氢氧化钠的含量将会偏高(填“偏高”、“不变”、或者“偏低”)
 甲、乙、丙三种物质的溶解度曲线如图.根据图中信息回答下列问题:
甲、乙、丙三种物质的溶解度曲线如图.根据图中信息回答下列问题: