题目内容
17. 将等质量的锌粉和铁粉,分别放入相同质量分数的足量稀盐酸中,反应生成H2的质量与反应时间的关系如图所示,据图回答:
将等质量的锌粉和铁粉,分别放入相同质量分数的足量稀盐酸中,反应生成H2的质量与反应时间的关系如图所示,据图回答:(1)金属X是铁,判断理由等质量的锌粉和铁粉分别放入相同质量分数的足量稀盐酸中,铁产生的氢气比锌多.
(2)消耗酸多的是铁,反应的化学方程式是Fe+2HCl=FeCl2+H2↑.
(3)从图中你还能获得的信息有:锌比铁活泼.(写一条)
分析 (1)根据等质量的铁与锌与足量酸反应生成氢气的多少考虑;
(2)根据质量守恒定律可知,氢元素来自酸,所以消耗酸多的是铁,铁和盐酸反应生成硫酸亚铁和氢气进行分析;
(3)根据图示信息可知谁先到达最高点,谁活泼反应的速度快进行分析.
解答 解:(1)由于锌和铁在与盐酸反应时得到的盐溶液中金属元素的化合价都是+2价,化合价相同时相对原子质量越小产生氢气质量越多,相对原子质量越大产生氢气质量越少,所以铁产生氢气比锌多,所以X是铁;
(2)质量守恒定律可知,氢元素来自酸,所以消耗酸多的是铁,铁和盐酸反应生成硫酸亚铁和氢气,化学方程式为:Fe+2HCl=FeCl2+H2↑;
(3)金属活动性越强,反应速度越快,用的时间就越短,所以最先到达最高点的说明该金属活泼.
故答案为:(1)铁;等质量的锌粉和铁粉分别放入相同质量分数的足量稀盐酸中,铁产生的氢气比锌多;
(2)铁,Fe+2HCl=FeCl2+H2↑;
(3)锌比铁活泼.
点评 解答本题关键是要知道化合价相同时相对原子质量越小产生氢气质量越多,相对原子质量越大产生氢气质量越少;最先到达最高点的金属反应速度最快.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
7. 如图所示,将滴管甲中的液体挤出,气球明显鼓起,一段时间后恢复原状,再将滴管乙中的液体挤出,气球又明显鼓起且不恢复原状.则滴管甲、乙和烧杯①②中的物质可能是( )
如图所示,将滴管甲中的液体挤出,气球明显鼓起,一段时间后恢复原状,再将滴管乙中的液体挤出,气球又明显鼓起且不恢复原状.则滴管甲、乙和烧杯①②中的物质可能是( )
 如图所示,将滴管甲中的液体挤出,气球明显鼓起,一段时间后恢复原状,再将滴管乙中的液体挤出,气球又明显鼓起且不恢复原状.则滴管甲、乙和烧杯①②中的物质可能是( )
如图所示,将滴管甲中的液体挤出,气球明显鼓起,一段时间后恢复原状,再将滴管乙中的液体挤出,气球又明显鼓起且不恢复原状.则滴管甲、乙和烧杯①②中的物质可能是( )| A. | 甲:水,①:食盐; 乙:水,②:蔗糖 | |
| B. | 甲:水①硝酸铵; 乙:稀盐胶,②:铁 | |
| C. | 甲:水①氢氧化钠; 乙:稀硫酸 ②:锌 | |
| D. | 甲:水①生石灰; 乙:稀盐酸 ②:氢氧化钠 |
8.下列反应属于氧化还原反应的是( )
| A. | CO2+Ca(OH)2→CaCO3↓+H2O | B. | S+O2 $\stackrel{点燃}{→}$ SO2 | ||
| C. | CuSO4+2NaOH→Cu(OH)2↓+Na2SO4 | D. | CaCO3 $\stackrel{焙烧}{→}$CaO+CO2↑ |
5.下列知识整理的内容有错误的一组是( )
| A、性质决定用途 | B、性质不同的原因 |
| 金刚石天然最硬:划玻璃 石墨能导电:做电极,电刷 活性炭有吸附性:吸附毒气 | 金刚石与石墨:碳原子排列方式不同 CO 与 CO2:分子构成不同 |
| C、气体的比较 | D、问题解决方案 |
| 氧气:能使带火星的木条复燃 二氧化碳:能使澄清的石灰水变浑浊 一氧化碳:能使人中毒 | 温室效应:开发使用清洁能源 大气污染:积极植树造林,种草 防一氧化碳中毒:煤炉上放一壶水 |
| A. | A | B. | B | C. | C | D. | D |
9.镍镉(Ni-Cd)电池中发生的反应为:Cd+2NiO(OH)+2H2O═2Ni(OH)2+Cd(OH)2.则在NiO(OH)和Cd(OH)2中,Ni和Cd的化合价分别为( )
| A. | +2,+3 | B. | +3,+2 | C. | +2,+2 | D. | +3,+3 |
6.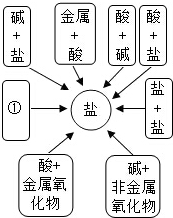 分类法是学习化学的重要思想方法.
分类法是学习化学的重要思想方法.
(1)人们可以对物质从不同的角度进行分类.请根据示例将酒精、醋酸、水、食盐四种物质进行分类,
并写出分类依据.
(2)某同学从物质类别的角度构建了如“图一”所示的知识网络图,借助网络图回答:
①写出用酸和碱生成氯化钠的化学方程式NaOH+HCl=NaCl+H2O.
②请把如图中①处补充完整,要求不能与图中已有信息重复.则①处应填写的内容是盐+金属.
③铁的金属活动性比铜强(选填:“强”或“弱”).可证明该结论的化学方程式是Fe+CuSO4=FeSO4+Cu.
 分类法是学习化学的重要思想方法.
分类法是学习化学的重要思想方法.(1)人们可以对物质从不同的角度进行分类.请根据示例将酒精、醋酸、水、食盐四种物质进行分类,
并写出分类依据.
| 不同类的物质 | 分类依据 | |
| 示例 | 水 | 水是氧化物,其余不是氧化物 |
| 分类一 | 食盐 | 常温下食盐是固体,其余是液体 |
| 分类二 | 醋酸 | 醋酸是酸,其余的不是酸 |
①写出用酸和碱生成氯化钠的化学方程式NaOH+HCl=NaCl+H2O.
②请把如图中①处补充完整,要求不能与图中已有信息重复.则①处应填写的内容是盐+金属.
③铁的金属活动性比铜强(选填:“强”或“弱”).可证明该结论的化学方程式是Fe+CuSO4=FeSO4+Cu.
 X、Y两种固体物质的溶解度曲线如图所示.回答下列问题:
X、Y两种固体物质的溶解度曲线如图所示.回答下列问题: