题目内容
7.下列四种金属中,有一种金属能与其余三种金属的盐溶液反应,则该金属是( )| A. | Mg | B. | Cu | C. | Fe | D. | Ag |
分析 在金属活动性顺序表中,位于前面的金属能把位于它后面的金属从其盐溶液中置换出来,据此进行分析解答.
解答 解:题目的四种金属中金属活动性顺序为Mg>Fe>Cu>Ag,根据在金属活动性顺序中位于前面的金属可以把位于后面的金属从它的盐的溶液中置换出来,由题意:有一种金属的盐溶液与另外三种金属单质都能发生反应,可知其它金属都排在了该金属的前面,即该金属是四种金属中最不活泼的,该金属为Ag.
故选:D.
点评 本题难度不大,考查金属活动性应用,掌握金属活动性应用“反应则活泼、不反应则不活泼”是正确解答此类题的关键.

练习册系列答案
相关题目
18.难溶性杂卤石属于“呆矿”,主要成分有K2SO4、MgSO4、CaSO4、不溶性杂质等(假设杂质不参加反应),为能充分利用钾资源,某工厂用溶浸杂卤石制备硫酸钾,工艺流程如下:
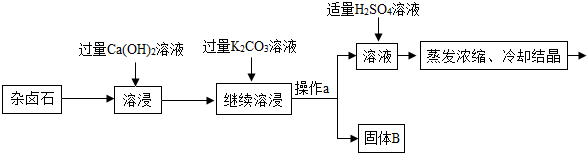
(1)在实验流程中加入过量的Ca(OH)2溶液,目的是除去主要成分中的MgSO4;发生反应的化学方程式是MgSO4+Ca(OH)2=Mg(OH)2↓+CaSO4.
(2)操作a的名称是过滤.
(3)请写出固体B的两种主要成分Mg(OH)2、CaCO3(用化学式表示)
(4)在使用Ca(OH)2溶液和K2CO3溶液对杂卤石进行“溶浸”时,为探究获得较高浸出杂卤石主要成分的浸取率,某实验小组用测得浸取液中K+的质量分数来表示浸取率,在相同的时间里,进行了如表实验组:
①上述实验的数据中,温度与K+浸取率的关系是温度越高,K+浸取率越高.
②如表5组实验中,若要获得最佳的K+浸取率,选择的反应条件是60℃和Ca(OH)23g.

(1)在实验流程中加入过量的Ca(OH)2溶液,目的是除去主要成分中的MgSO4;发生反应的化学方程式是MgSO4+Ca(OH)2=Mg(OH)2↓+CaSO4.
(2)操作a的名称是过滤.
(3)请写出固体B的两种主要成分Mg(OH)2、CaCO3(用化学式表示)
(4)在使用Ca(OH)2溶液和K2CO3溶液对杂卤石进行“溶浸”时,为探究获得较高浸出杂卤石主要成分的浸取率,某实验小组用测得浸取液中K+的质量分数来表示浸取率,在相同的时间里,进行了如表实验组:
| 实验 | 温度/℃ | Ca(OH)2用量/g | K+浸取率/% |
| a | 25 | 2.5 | 72.4 |
| b | 40 | 2.5 | 86.55 |
| c | 40 | 3 | 90.02 |
| d | 60 | 3 | 91.98 |
| e | 60 | 4 | 91.45 |
②如表5组实验中,若要获得最佳的K+浸取率,选择的反应条件是60℃和Ca(OH)23g.
15.要证明稀硫酸中含有盐酸所需药品正确的滴加顺序是( )
| A. | 先滴加AgNO3溶液再滴加BaCl2溶液 | |
| B. | 先滴加BaCl2 溶液再滴加AgNO3溶液 | |
| C. | 先滴加Ba(NO3)2 溶液再滴加AgNO3溶液 | |
| D. | 先滴加AgNO3 溶液再滴加Ba(NO3)2溶液 |
2.下列微粒中,能够保持二氧化碳的化学性质的是( )
| A. | O和C | B. | CO32- | C. | O2和C | D. | CO2 |
12.下列各组物质在溶液中能大量共存且形成无色溶液的是( )
| A. | K2CO3 HCl Na2SO4 | B. | KNO3 HCl NaCl | ||
| C. | H2SO4 FeCl3 KOH | D. | CuSO4 HCl NaNO3 |
17.山梨酸钾化学式为C5H7COOK,是一种安全高效的食品防腐剂,下列说法正确的是( )
| A. | 山梨酸钾中含有六种元素 | |
| B. | 山梨酸钾中碳元素的质量分数为48% | |
| C. | 每个山梨酸钾分子中都含有1个钾元素 | |
| D. | 山梨酸钾是由6个碳原子、7个氢原子、2个氧原子和1个钾原子构成的 |
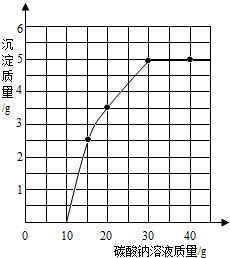 实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如图所示.
实验室用过量的稀盐酸和大理石制取CO2,取50g反应后的滤液,逐滴滴入碳酸钠溶液,测得滴入碳酸钠溶液的质量与产生沉淀质量的关系曲线如图所示.