题目内容
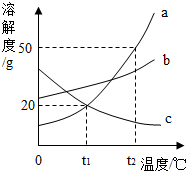 如图是a、b、c三种固体物质的溶解度曲线
如图是a、b、c三种固体物质的溶解度曲线(1)在t1℃时,a、b、c三种物质中,溶解度最大的是
(2)t1℃时,将30g a物质放入100g水中,充分搅拌,所形成的溶液是
(3)从a、c的饱和溶液中提取a,应采用方法是
考点:固体溶解度曲线及其作用,结晶的原理、方法及其应用,饱和溶液和不饱和溶液相互转变的方法
专题:溶液、浊液与溶解度
分析:(1)据溶解度曲线可比较同一温度下不同物质的溶解度大小;
(2)据该温度下a的溶解度、溶质的质量分数计算法、以及a在t1℃和t2℃的溶解度分析解答;
(3)据物质的溶解度受温度影响情况分析提纯物质的方法.
(2)据该温度下a的溶解度、溶质的质量分数计算法、以及a在t1℃和t2℃的溶解度分析解答;
(3)据物质的溶解度受温度影响情况分析提纯物质的方法.
解答:解:(1)由图可知:在t1℃时,a、b、c三种物质中,溶解度最大的是 b;
(2)t1℃时a的溶解度是20g,即100g水中最多溶解20g 的a,所以将30g a物质放入100g水中,充分搅拌,所形成的溶液是 饱和溶液;溶液中溶质质量分数是
×100%≈16.7%;此时若将温度由t1℃升至t2℃,其溶解度变为50g,溶液中已经有了30g的a,所以还应再加入a物质 20g,才能变成饱和溶液;
(3)由图可知:a的溶解度随温度升高而增大,c的溶解度随温度升高而减小,所以从a、c的饱和溶液中提取a,应采用冷却热饱和溶液的方法;
故答案为:(1)b; (2)饱和; 16.7%; 20;(3)冷却结晶.
(2)t1℃时a的溶解度是20g,即100g水中最多溶解20g 的a,所以将30g a物质放入100g水中,充分搅拌,所形成的溶液是 饱和溶液;溶液中溶质质量分数是
| 20g |
| 120g |
(3)由图可知:a的溶解度随温度升高而增大,c的溶解度随温度升高而减小,所以从a、c的饱和溶液中提取a,应采用冷却热饱和溶液的方法;
故答案为:(1)b; (2)饱和; 16.7%; 20;(3)冷却结晶.
点评:溶解度是某温度下100g水中最多溶解某物质的质量,了解其含义即溶质的质量分数计算方法,并能据溶解度受温度影响情况分析提纯物质的方法,同学们对知识要在理解的基础上记忆,才能正确分析解答.

练习册系列答案
相关题目
2014年6月5日世界环境日中国主题为“向污染宣战”,倡导全社会共同行动,打一场治理污染的攻坚战,努力改善环境质量,保卫我们赖以生存的共同家园.下列说法或做法不合理的是( )
| A、日常生活提倡用布袋代替塑料袋 |
| B、公交出行,少用私车 |
| C、为便于使用,电脑一直处于待机状态 |
| D、随手关灯,节约用电 |
下列化学方程式书写正确的是( )
| A、S+O2=SO2 | ||||
B、Cu+O2
| ||||
C、C+CuO
| ||||
D、4P+5O2
|
 甲、乙两种不含结晶水的固体物质的溶解度曲线如图,下列说法中正确的是( )
甲、乙两种不含结晶水的固体物质的溶解度曲线如图,下列说法中正确的是( )| A、甲的溶解度大于乙的溶解度 |
| B、35℃时100g甲的饱和溶液中含甲的质量为60g |
| C、降低温度可使甲的饱和溶液中有晶体析出 |
| D、10℃时甲、乙两种溶液的溶质质量分数一定相等 |



