题目内容
某碳酸钠样品中含有少量氯化钠,现称量该样品11g放入烧杯中,再加入50g稀盐酸.恰好完全反应,称得烧杯中的溶液质量为56.6g.请计算;所用盐酸的溶质的质量分数.
考点:根据化学反应方程式的计算,有关溶质质量分数的简单计算
专题:溶质质量分数与化学方程式相结合的计算
分析:根据质量守恒定律可计算出二氧化碳的质量,根据化学方程式中二氧化碳和盐酸的质量比可求出氯化氢的质量,进而计算出盐酸溶液的溶质质量分数.
解答:解:由质量守恒定律可得二氧化碳的质量:11g+50g-56.6g=4.4g
设盐酸中溶质的质量为x,
Na2CO3+2HCl═2NaCl+H2O+CO2↑
73 44
x 4.4g
=
x=7.3g
×100%=14.6%
答,所用盐酸的溶质的质量分数14.6%.
设盐酸中溶质的质量为x,
Na2CO3+2HCl═2NaCl+H2O+CO2↑
73 44
x 4.4g
| 73 |
| x |
| 44 |
| 4.4g |
x=7.3g
| 7.3g |
| 50g |
答,所用盐酸的溶质的质量分数14.6%.
点评:要想解答好这类题目,要理解和熟记根据化学反应方程式的计算步骤、格式以及与之相关的知识等,难度不大.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案
相关题目
既可以用浓硫酸又可以用氢氧化钠干燥的一组气体是( )
| A、氢气 氯化氢 氧气 |
| B、一氧化碳 二氧化碳 二氧化硫 |
| C、氮气 氢气 一氧化碳 |
| D、氨气 二氧化硫 氯化氢 |
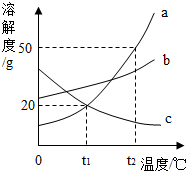 如图是a、b、c三种固体物质的溶解度曲线
如图是a、b、c三种固体物质的溶解度曲线
 实验室有下列仪器可供选用(铁架台、导管、橡皮塞等一省略).
实验室有下列仪器可供选用(铁架台、导管、橡皮塞等一省略).

