题目内容
某同学在做实验时得知氯化钠样品中含有少量泥沙、氯化钙和氯化镁,于是设计以下流程除去氯化钠的样品中泥沙、氯化钙和氯化镁.

(1)操作Ⅰ的名称是 ,试剂A是 ,试剂B是 .
(2)写出NaOH与杂质反应的化学方程式 .
(3)蒸发结晶时玻璃棒的作用是 .
(4)用提纯后的氯化钠固体来配置50g质量分数为6%的氯化钠溶液,其步骤为:①计算、②称量、③ 、④溶解、⑤装入试剂瓶中,盖好瓶塞并 .

(1)操作Ⅰ的名称是
(2)写出NaOH与杂质反应的化学方程式
(3)蒸发结晶时玻璃棒的作用是
(4)用提纯后的氯化钠固体来配置50g质量分数为6%的氯化钠溶液,其步骤为:①计算、②称量、③
考点:氯化钠与粗盐提纯,一定溶质质量分数的溶液的配制,过滤的原理、方法及其应用,蒸发与蒸馏操作,盐的化学性质
专题:溶液、浊液与溶解度,常见的盐 化学肥料
分析:根据除杂质氯化镁的方法考虑,氯化镁与氢氧化钠反应生成氢氧化镁白色沉淀和氯化钠;
氯化钙与碳酸钠反应生成氯化钠和碳酸钙白色沉淀,可以除去氯化钙;书写方程式,根据反应物、生成物配平即可;
根据过量试剂会成为新的杂质,也要除去考虑;
根据玻璃棒的用途考虑.
根据溶质质量=溶液质量×溶质质量分数求出溶质质量,根据配制溶液的步骤分析所用的仪器.
氯化钙与碳酸钠反应生成氯化钠和碳酸钙白色沉淀,可以除去氯化钙;书写方程式,根据反应物、生成物配平即可;
根据过量试剂会成为新的杂质,也要除去考虑;
根据玻璃棒的用途考虑.
根据溶质质量=溶液质量×溶质质量分数求出溶质质量,根据配制溶液的步骤分析所用的仪器.
解答:解:(1)经过过滤操作能除去粗盐中含有的不溶性固体杂质,NaOH溶液可以除去杂质氯化镁,要除去氯化钙可以加入碳酸钠,故A是碳酸钠,所得的滤液含有有过量的氢氧化钠和碳酸钠,可以加入盐酸除去,故B是盐酸,故填:过滤;碳酸钠,盐酸;
(2)氯化镁与氢氧化钠反应生成氢氧化镁白色沉淀和氯化钠,方程式为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl,故填:MgCl2+2NaOH═Mg(OH)2↓+2NaCl;
(3)在蒸发中,玻璃棒起搅拌作用,防止局部温度过高造成液滴飞溅,故填:搅拌,使受热均匀;
(4)配制氯化钠溶液的步骤是计算、称量、量取、溶解、装瓶存放、并写上标签,故填:量取,写上标签.
(2)氯化镁与氢氧化钠反应生成氢氧化镁白色沉淀和氯化钠,方程式为:MgCl2+2NaOH═Mg(OH)2↓+2NaCl,故填:MgCl2+2NaOH═Mg(OH)2↓+2NaCl;
(3)在蒸发中,玻璃棒起搅拌作用,防止局部温度过高造成液滴飞溅,故填:搅拌,使受热均匀;
(4)配制氯化钠溶液的步骤是计算、称量、量取、溶解、装瓶存放、并写上标签,故填:量取,写上标签.
点评:除杂质时加入的试剂只能与杂质反应,不能引入新的杂质,将不溶于液体的固体和液体分离用过滤的方法,把可溶性固体与液体分开用蒸发的方法.

练习册系列答案
相关题目
 氧化物与X的关系可用如图表示,则X是( )
氧化物与X的关系可用如图表示,则X是( )| A、单质 | B、化合物 |
| C、混合物 | D、金属氧化物 |
氧元素和硫元素的本质区别是( )
| A、质子数不同 |
| B、电子数不同 |
| C、中子数不同 |
| D、最外层电子数不同 |
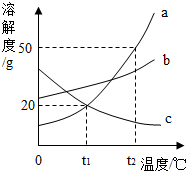 如图是a、b、c三种固体物质的溶解度曲线
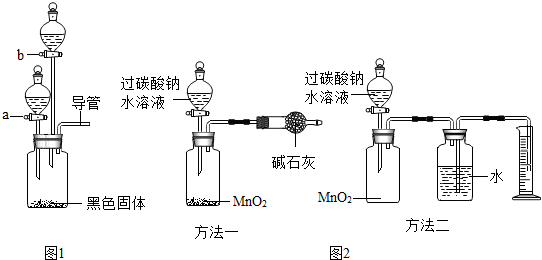
如图是a、b、c三种固体物质的溶解度曲线 如图装置可以完成多个简单实验,具有药品用量少、实验现象明显、尾气不外逸等优点.
如图装置可以完成多个简单实验,具有药品用量少、实验现象明显、尾气不外逸等优点.