题目内容
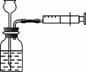
在氯化钙和氯化钠的混合物中加入一定量的水,全部溶解得到50克混合溶液,向该溶液中逐滴加入一定溶质质量分数的碳酸钠溶液,生成沉淀与加入碳酸钠溶液的质量关系如图所示.计算:
(1)所加碳酸钠溶液的溶质质量分数.
(2)若恰好完全反应时所得溶液的溶质质量分数为10%,则原固体混合物的质量是多少?

考点:
根据化学反应方程式的计算;有关溶质质量分数的简单计算.
专题:
综合计算(图像型、表格型、情景型计算题).
分析:
(1)根据沉淀的质量和方程式计算碳酸钠和氯化钠的质量,进一步计算碳酸钠溶液的溶质质量分数.
(2)根据恰好完全反应时溶液中溶质的质量分数公式分析.
解答:
解:(1)由图象可知,CaCO3的质量为5g,
设原混合物中碳酸钠的质量为x,生成氯化钠的质量为y.
Na2CO3+CaCl2═CaCO3↓+2NaCl
106 100 117
x 5g y
 =
= =
=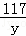
x=5.3g,y=5.85g
所加碳酸钠溶液的溶质质量分数为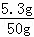 ×100%=10.6%
×100%=10.6%
(3)原固体混合物的质量是w
所以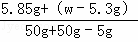 ×100%=10%
×100%=10%
w=8.95g
答:(1)所加碳酸钠溶液的溶质质量分数为10.6%
(2)原固体混合物的质量是8.95g
点评:
本题主要考查学生对完全反应的认识,以及应用公式和化学方程式进行正确计算的能力,学生必须有牢固的知识,再加上认真细心的态度,方可完成

小瑾同学用图表对所学知识进行归纳,其中甲包含乙和丙,不包含丁,下列关系错误的是( )
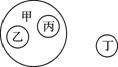
| 甲 | 乙 | 丙 | 丁 | |
| A | 碱 | 烧碱 | 氢氧化钾 | 纯碱 |
| B | 合成材料 | 塑料 | 合成纤维 | 合成橡胶 |
| C | 溶液 | 糖水 | 生理盐水 | 泥浆 |
| D | 化石燃料 | 石油 | 煤 | 酒精 |
为测定某氨肥中硫酸铵的纯度(即质量分数)是否与如图标签相符,小林取一定量该氨肥样品与烧杯中配成溶液与足量氯化钡溶液反应,记录有关数据如下表
| 反应前 | 反应后 |
|
| 烧杯和样品溶液总质量 | 氯化钡溶液质量 | 过滤后烧杯和溶液总质量(滤液的损失忽略不计) |
| 45g | 55g | 76.7g |
【反应的化学方程式为(NH4)2SO4+BaCl2═BaSO4↓+2NH4Cl4,其他成分能溶于水但不参加反应】
(1)反应共生成BaSO4的质量为 g
(2)若所取氨肥样品的质量为15g,试通过计算确定氨肥中硫酸铵的纯度是否与标签相符.(请写出计算过程)
(3)反应前后,溶液中硫元素的质量 (填“不变”、“增大”或“减小”)

属于钾肥的是( )
|
| A. | NH3•H2O | B. | KCl | C. | NH4Cl | D. | Ca3(PO4)2 |
 O→Cu(OH)2 B.K2SO4→KNO3→KCl
O→Cu(OH)2 B.K2SO4→KNO3→KCl
 对人体有害
对人体有害