题目内容
某碳酸钠样品含有少量的硫酸钠,取一定质量的该样品,完全溶解在水中配制成100g溶液,将其全部加入到100g一定质量分数的硫酸溶液中,恰好完全反应,生成的气体全部逸出后,所得溶液质量是195.6g,将溶液蒸干,得到15.6g硫酸钠.
计算:
(1)加入的硫酸溶液的溶质质量分数;
(2)原碳酸钠样品中碳酸钠的质量分数(计算结果精确到0.1%).
考点:
根据化学反应方程式的计算;有关溶质质量分数的简单计算.
专题:
溶质质量分数与化学方程式相结合的计算.
分析:
根据质量守恒定律,求出生成二氧化碳的质量,再根据化学方程式求出样品中碳酸钠的质量,参加反应的硫酸质量和生成硫酸钠的质量,最后求出加入的硫酸溶液的溶质质量分数和原碳酸钠样品中碳酸钠的质量分数.
解答:
解:生成二氧化碳的质量为100g+100g﹣195.6g=4.4g;
设样品中碳酸钠的质量为x,反应的硫酸质量为y,生成硫酸钠的质量为z
Na2CO3 +H2SO4═Na2SO4 +CO2↑+H2O
106 98 142 44
x y z 4.4g
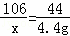 ,x=10.6g
,x=10.6g
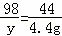 ,y=9.8g
,y=9.8g
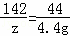 ,z=14.2g
,z=14.2g
(1)加入的硫酸溶液的溶质质量分数:
(2)原碳酸钠样品中碳酸钠的质量分数为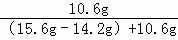 ×100%=88.3%
×100%=88.3%
答:加入的硫酸溶液的溶质质量分数为9.8%,原碳酸钠样品中碳酸钠的质量分数为88.3%.
点评:
据化学方程式可以表示反应中各物质的质量关系,由其中任意一种物质的质量可计算反应中其它物质的质量.

六硅酸镁可表示为aMgO•6SiO2•bH2O.确定六硅酸镁组成的方法是:取10.6g六硅酸镁,充分加热失水后,得固体8.8g;另取相同质量的六硅酸镁加入足量盐酸,充分反应后,经处理得SiO2固体7.2g,下列说法正确的是( )
|
| A. | a=2 | B. | a=3 | C. | b=5 | D. | b=7 |
小明为了测定某钙片中碳酸钙的质量分数,用如图装置进行如下实验:
①取研碎后的钙片4克,导入气密性良好的锥形瓶中,然后在分液漏斗中加入适量的稀盐酸,置于电子天平上测出装置总质量.
②打开活塞,滴入足量稀盐酸后关闭活塞,待气泡不再冒出时,测出反应后装置总质量.
③整理相关数据如表所示,计算出钙片中碳酸钙的质量分数.
| 反应前总质量(克) | 275.58 |
| 反应后总质量(克) | 274.92 |
| 反应前后总质量差(克) | 0.66 |
| 容器内气体质量差(克) | m |
(1)该实验中,对装置中的固态干燥剂的性质有何要求?
(2)反应前容器内是空气(密度为ρ1),反应后全部是二氧化碳(密度为ρ2),则反应前后容器(容积为V)内的气体质量差为m为 .(用字母表示,反应物的体积忽略不计)
(3)小明查阅有关数据后,计算出反应前后容器内的气体质量差m为0.22克,结合表中数据,计算该钙片中碳酸钙的质量分数.(CaCO3+2HCl=CaCl2+H2O+CO2↑).钙片中的其它成分不与盐酸反应.

下列物质属于氮肥的是( )
|
| A. | 熟石灰 | B. | 硫酸钾 | C. | 过磷酸钙 | D. | 氯化铵 |
 方法,错误的是( )
方法,错误的是( )