题目内容
11.木炭还原氧化铜实验后的混合粉末中含有铜、氧化铜、木炭粉,某化学实验小组设计回收铜的方案如下:(1)过滤操作中必须用到的玻璃仪器有烧杯、玻璃棒和漏斗,其中玻璃棒的作用是引流.
(2)写出反应①的化学方程式.
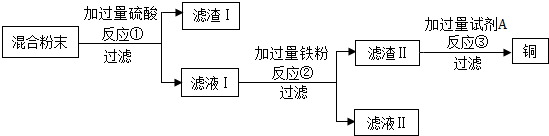
(3)滤液Ⅱ中的溶质是什么?试剂A最好选用的溶液是什么?
分析 (1)根据过滤的操作和仪器的作用分析回答
(2)根据混合物的成分和实验的目的分析发生的反应写出反应的化学方程式;
(3)根据滤液Ⅰ含有的溶质分析加入足量的铁后过滤得到滤液Ⅱ中的溶质,要除去铜粉中的铁粉,可加入稀硫酸,据此分析解答.
解答 解:(1)过滤操作中必须用到的玻璃仪器有烧杯、玻璃棒和漏斗,其中玻璃棒的作用是引流.
(2)由于木炭还原氧化铜实验后的混合粉末中含有铜、氧化铜、木炭粉,加入足量的硫酸时氧化铜与硫酸反应生成硫酸铜和水,铜、木炭与硫酸不反应,化学方程式为:H2SO4+CuO═CuSO4+H2O;
(3)由流程图可知,上述反应过滤后的滤液中加入过量的铁粉,铁粉和硫酸铜反应生成硫酸亚铁和铜,铁粉和硫酸反应生成硫酸亚铁和氢气,铜不和硫酸反应,所以,滤液Ⅱ中的溶质是硫酸亚铁.滤渣Ⅱ中含有铜
和剩余的铁,为了得到铜,应将铁除去,应加入过量的试剂A最好是稀硫酸.
答案:(1)漏斗,引流;(2)H2SO4+CuO═CuSO4+H2O;(3)硫酸亚铁,稀硫酸.
点评 对于流程图的题目关健是看明白流程图中各物质的转化关系,注意过量物质的去向,如何除去过量物质.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
19. 甲、乙两物质的溶解度曲线如图,将等质量的t2℃甲、乙饱和溶液分别降温到t1℃.下列说法一定正确的是( )
甲、乙两物质的溶解度曲线如图,将等质量的t2℃甲、乙饱和溶液分别降温到t1℃.下列说法一定正确的是( )
 甲、乙两物质的溶解度曲线如图,将等质量的t2℃甲、乙饱和溶液分别降温到t1℃.下列说法一定正确的是( )
甲、乙两物质的溶解度曲线如图,将等质量的t2℃甲、乙饱和溶液分别降温到t1℃.下列说法一定正确的是( )| A. | 两溶液仍饱和 | B. | 此时溶解度相等 | ||
| C. | 溶质质量分数:甲=乙 | D. | 溶液质量:甲=乙 |
16.工业用盐亚硝酸钠(NaNO2)有毒,其外观与食盐极为相似,其氮元素的化合价为( )
| A. | +1 | B. | +2 | C. | +3 | D. | +4 |
3.下列所示变化中与其他三种变化有着本质不同的是( )
| A. | 火药爆炸 | B. | 衣服晒干 | C. | 纸张燃烧 | D. | 酒变酸 |
20. 甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示,下列说法不正确的是( )
甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示,下列说法不正确的是( )
 甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示,下列说法不正确的是( )
甲、乙两种不含结晶水的固体物质的溶解度曲线如图所示,下列说法不正确的是( )| A. | t2℃时,甲的溶解度与乙的溶解度相等 | |
| B. | t3℃时,甲饱和溶液的溶质质量分数大于乙饱和溶液的溶质质量分数 | |
| C. | 浓的甲溶液中含有少量乙,可以采用加热浓缩后降温结晶的方法得到较纯净的甲晶体 | |
| D. | t1℃时,20g甲物质加入到80g水中,可以得到100g甲溶液 |
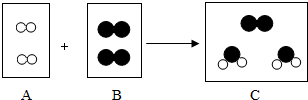 在宏观、微观和符号之间建立联系,是化不学科的特点.如图是某化学反应的微观过程示意图(“
在宏观、微观和符号之间建立联系,是化不学科的特点.如图是某化学反应的微观过程示意图(“ ”表示氧原子,“
”表示氧原子,“ ”表示氢原子).
”表示氢原子). 如图表示某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液与20g某稀盐酸发生反应后溶液温度的变化情况,查阅资料可知,氢氧化钠和盐酸反应会放出热量.
如图表示某化学兴趣小组的同学在实验室配制质量分数为8%的氢氧化钠溶液与20g某稀盐酸发生反应后溶液温度的变化情况,查阅资料可知,氢氧化钠和盐酸反应会放出热量.