题目内容
19. 某校化学兴趣小组就空气中氧气的含量进行了如下实验探究
某校化学兴趣小组就空气中氧气的含量进行了如下实验探究【集体讨论】(1)讨论后同学们认为,选择的药品既要能消耗氧气,又不会跟空气中的其他成分反应而且生成物为固体.他们应该选择B(填序号),为了充分消耗容器中的氧气,药品的用量应保证足量.
A、蜡烛 B、红磷 C、硫 D、木炭
(2)小组同学共同设计如图所示的两套装置,你认为合理的是A(填序号).为了确保实验的成功,在装药品之前应该检查装置的气密性.
【分组实验】在讨论的基础上,他们分组进行了实验.
【数据分析】实验结束后,整理数据如表:(注:集气瓶容积为100mL)
| 组别 | 1 | 2 | 3 | 4 | 5 | 6 |
| 进入集气瓶中水的体积/mL | 20 | 21 | 19 | 20 | 22 | 19 |
分析 (1)蜡烛、硫和木炭与氧气反应,生成物中有气体,不能准确测定空气中氧气的含量,只有红磷在空气中与氧气反应生成固体物质,不影响空气成分的测定,据此分析判断;
(2)为保证红磷与空气中的氧气充分反应,必须把红磷放在集气瓶的中下部;在测定空气中氧气的含量时,由于氧气参加了反应,瓶内压强减小,应检查装置的气密性;
(3)通过实验数据分析空气中氧气的体积分数,根据实验的现象分析剩余气体的性质.
解答 解:(1)蜡烛、硫和木炭与氧气反应,生成物中有气体,不能准确测定空气中氧气的含量,红磷不会跟空气中的其他成分反应,而且生成物为五氧化二磷固体;所以在测定空气中氧气的含量是应选用红磷;只有红磷足量或过量,才能完全消耗集气瓶中的氧气;
(2)为保证红磷与空气中的氧气充分反应,必须把红磷放在集气瓶的中下部;两套装置,合理的是A装置;为了确保实验的成功,在装药品之前应该检查装置的气密性.
(3)根据6组数据的平均值是20mL,说明氧气约占空气体积的五分之一;通过实验还可以推断集气瓶中剩余气体的性质是难溶于水,不能燃烧,不支持燃烧等.
故答为:(1)B;足量;(2)A;检查装置的气密性;(3)$\frac{1}{5}$;难溶于水;不能燃烧;不支持燃烧.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

练习册系列答案
相关题目
7.下面是对四个实验绘制的图形,其中实验结果与图形对应不正确的是( )
| A. |  向两份完全相同的稀H2SO4中分别加入足量的锌粉、镁粉 | |
| B. |  向一定量的稀盐酸中加入过量的NaOH溶液 | |
| C. |  加热一定质量的KMnO4固体 | |
| D. |  将一定量的浓H2SO4敞口放置在空气中 |
6.小林探究了影响物质溶解性的因素后.小林还认为:溶剂的多少也会影响物质溶解性.于是他进行相应的探究,请完成下列实验设计和问题交流.
【实验设计】
【问题交流】
(1)请你从控制变量角度优化步骤②向A烧杯倒入20克20℃的水,向B烧杯倒入60克20℃的水;
(2)步骤④需记录的是剩余食盐的质量;
(3)多次重复实验后,小林发现A、B两组在相同的条件下每10克水最多溶解食盐质量基本相同,于是得出结论:溶剂的多少不会影响物质溶解性.小红认为该实验还不具有普遍性.理由是加入水的质量相等.
【实验设计】
| 实验步骤 | 设计要求 |
| ①准备两个大小相同的烧杯,分别标为A、B;向两烧杯中分别倒入30克粗细相同的食盐. | 选择合适的实验器材 |
| ②向A烧杯倒入20克水,向B烧杯倒入60克水. | 设置对照实验 |
| ③都用玻璃棒充分搅拌直到A、B两烧杯底部的食盐不再溶解为止,过滤、干燥剩余食盐 | 控制实验条件 |
| ④称量并记录,并进行统计分析. | 观察和记录 |
(1)请你从控制变量角度优化步骤②向A烧杯倒入20克20℃的水,向B烧杯倒入60克20℃的水;
(2)步骤④需记录的是剩余食盐的质量;
(3)多次重复实验后,小林发现A、B两组在相同的条件下每10克水最多溶解食盐质量基本相同,于是得出结论:溶剂的多少不会影响物质溶解性.小红认为该实验还不具有普遍性.理由是加入水的质量相等.
3.人类社会的发展需要充足的能源、丰富的材料、良好的环境.广阔的海洋中蕴含着无穷的资源,开发海洋,利用海洋成为人们关注的热点.利用粗盐,可以进一步获得纯碱.请你利用以下信息对相关问题进行研究.
【生产流程】
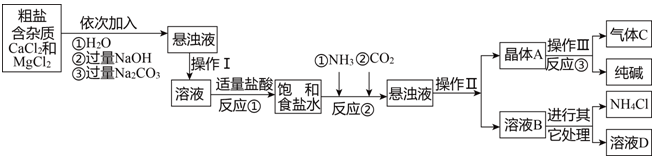
【产品与原理】
采用“侯氏制减法”生产工产品--纯碱和化肥NH4Cl.
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应为NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl;分离出NaHCO3,加热制得纯碱.
【相关资料】
已知20℃时有关物质的溶解度如下(气体值1体积水中能溶解的气体体积)
【问题讨论】
(1)操作Ⅰ、Ⅱ中,相同操作的名称为过滤.
(2)反应①中发生了2个反应.
(3)写出溶液B中除了NH4Cl的另一种溶质是碳酸氢钠.
(4)上述产生流程中可循环使用的是A(填序号).
A.挥发性气体CB.溶液BC.氢氧化镁D.化肥NH4Cl.
【生产流程】

【产品与原理】
采用“侯氏制减法”生产工产品--纯碱和化肥NH4Cl.
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3和NH4Cl的混合物,反应为NaCl(饱和)+NH3+CO2+H2O=NaHCO3↓+NH4Cl;分离出NaHCO3,加热制得纯碱.
【相关资料】
已知20℃时有关物质的溶解度如下(气体值1体积水中能溶解的气体体积)
| 物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
| 溶解度 | 36.0g | 9.6g | 37.2g | 710g | 0.9g |
(1)操作Ⅰ、Ⅱ中,相同操作的名称为过滤.
(2)反应①中发生了2个反应.
(3)写出溶液B中除了NH4Cl的另一种溶质是碳酸氢钠.
(4)上述产生流程中可循环使用的是A(填序号).
A.挥发性气体CB.溶液BC.氢氧化镁D.化肥NH4Cl.
4.提纯含少量泥沙的粗盐,一般经过如图所示的操作流程;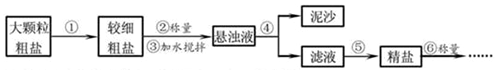
操作⑤中除了用到三脚架、玻璃棒、坩埚、坩埚钳外,还需要用到蒸发皿、酒精灯等仪器.
实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是ABD(填序号).
A.食盐没有全部溶解即过滤
B.蒸发时食盐飞溅剧烈
C.蒸发后,所得精盐很潮湿
D.器皿上沾有的精盐没全部转移到称量纸上.
根据氯化钠和硝酸钾在不同温度时的溶解度进行分析,要把硝酸钾从溶液中提取出来,采用的方法是降温结晶.

操作⑤中除了用到三脚架、玻璃棒、坩埚、坩埚钳外,还需要用到蒸发皿、酒精灯等仪器.
实验结束后称量获得的精盐,并计算精盐的制得率,发现制得率较低,其可能原因是ABD(填序号).
A.食盐没有全部溶解即过滤
B.蒸发时食盐飞溅剧烈
C.蒸发后,所得精盐很潮湿
D.器皿上沾有的精盐没全部转移到称量纸上.
根据氯化钠和硝酸钾在不同温度时的溶解度进行分析,要把硝酸钾从溶液中提取出来,采用的方法是降温结晶.
| 温度/℃ | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | 氯化钠 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| 硝酸钾 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
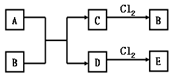 绝大多数金属都能与Cl2直接化合生成金属氯化物,如2Na+Cl2点燃═2NaCl,Cu+Cl2点燃═CuCl2等.已知A、B、C、D、E五种物质有如图转化关系(个别反应条件已略去).已知A是地壳中含量仅次于铝的金属元素的单质,C为紫红色金属单质,A、C都能与Cl2直接化合生成相应的金属氯化物B、E.回答下列问题:
绝大多数金属都能与Cl2直接化合生成金属氯化物,如2Na+Cl2点燃═2NaCl,Cu+Cl2点燃═CuCl2等.已知A、B、C、D、E五种物质有如图转化关系(个别反应条件已略去).已知A是地壳中含量仅次于铝的金属元素的单质,C为紫红色金属单质,A、C都能与Cl2直接化合生成相应的金属氯化物B、E.回答下列问题: