题目内容
15. 现有铜粉和镁粉的混合物样品,某兴趣小组要测定样品中镁的质量分数.他们称取该混合物样品10g置于烧杯中,然后加入350g一定质量分数的稀盐酸.所加稀盐酸的质量与产生氢气的质量关系如图所示.请计算:
现有铜粉和镁粉的混合物样品,某兴趣小组要测定样品中镁的质量分数.他们称取该混合物样品10g置于烧杯中,然后加入350g一定质量分数的稀盐酸.所加稀盐酸的质量与产生氢气的质量关系如图所示.请计算:(1)原混合物样品中镁的质量分数是多少?
(2)所用盐酸的质量分数是多少?
分析 (1)金属混合物中铜不能与所加稀盐酸反应,反应放出氢气的质量为镁与盐酸反应的结果,因此可根据产生氢气质量计算出金属混合物中镁的质量和消耗氯化氢的质量,进而求出样品中镁的质量分数;
(2)根据溶质的质量分数公式求解;
解答 解:由图象分析可知10g样品中镁完全反应后生成的氢气质量是0.5g,消耗盐酸的质量是250g;
设10g样品中含镁的质量为x,消耗HCl的质量为y,
Mg+2HCl=MgCl2+H2↑
24 73 2
x y 0.5g
$\frac{24}{x}=\frac{2}{0.5g}$
x=6g,
$\frac{73}{y}=\frac{2}{0.5g}$
y=18.25g
原混合物样品中镁的质量分数是 $\frac{6g}{10g}$×100%=60%
所用盐酸的质量分数是 $\frac{18.25g}{250g}×100%$=7.3%,
故答案为:(1)60%.(2)7.3%.
点评 此题是对化学反应方程式的考查,准确判断图中数值所表示的含义是正确解决本题一个重要细节.

练习册系列答案
相关题目
6. 已知M物质和氯化钠的溶解度与温度的关系如表所示
已知M物质和氯化钠的溶解度与温度的关系如表所示
(1)从海水中提纯食盐通常采取风吹日晒的方法,这是因为NaCl的溶解度受温度影响变化小(选填“大”或“小”)
(2)从表中数据中选择,25℃时,M物质的溶解度应不低于24.4%
(3)根据表分析,若要在某一温度下,分别配制溶质质量分数相等的M和NaCl饱和溶液,则该温度所在的范围是20~30℃
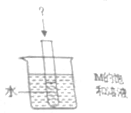
(4)如图,烧杯中盛放着30℃的M的饱和溶液,试管中有适量水,向试管中加入一种固体,过一会儿烧杯底部都有少量M的晶体析出,则试管中加入的固体可能是ACD(填字母)
A.冰块 B.氯化钠 C.干冰 D.硝酸铵 E.氢氧化钠
(5)M物质与下列物质混合(两者之间不发生化学反应),能用溶解、过滤、蒸发的方法分液的是AC(填字母) A.碳酸钙 B.食盐 C.铁粉 D.硝酸钾
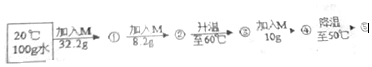
(6)向100g水中不断加入固体M或改变温度,得到如图所示的相应的溶液①②③④⑤这些溶液中为饱和溶液的是①②⑤(填序号)
 已知M物质和氯化钠的溶解度与温度的关系如表所示
已知M物质和氯化钠的溶解度与温度的关系如表所示| 温度/℃ | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | 物质M | 32.2 | 37.4 | 40.4 | 50.4 | 55.2 |
| 氯化钠(NaCl) | 35.7 | 35.8 | 36 | 36.3 | 36.6 | |
(2)从表中数据中选择,25℃时,M物质的溶解度应不低于24.4%
(3)根据表分析,若要在某一温度下,分别配制溶质质量分数相等的M和NaCl饱和溶液,则该温度所在的范围是20~30℃
(4)如图,烧杯中盛放着30℃的M的饱和溶液,试管中有适量水,向试管中加入一种固体,过一会儿烧杯底部都有少量M的晶体析出,则试管中加入的固体可能是ACD(填字母)
A.冰块 B.氯化钠 C.干冰 D.硝酸铵 E.氢氧化钠
(5)M物质与下列物质混合(两者之间不发生化学反应),能用溶解、过滤、蒸发的方法分液的是AC(填字母) A.碳酸钙 B.食盐 C.铁粉 D.硝酸钾
(6)向100g水中不断加入固体M或改变温度,得到如图所示的相应的溶液①②③④⑤这些溶液中为饱和溶液的是①②⑤(填序号)

10.下列关于物质组成与分类的说法中正确的是( )
| A. | 含有氧元素的化合物叫做氧化物 | |
| B. | 氯化钠的构成粒子是Na+和Cl- | |
| C. | 原子核是由质子和电子构成的 | |
| D. | NH3由一个氮元素和三个氢元素组成 |


