题目内容
6. 已知M物质和氯化钠的溶解度与温度的关系如表所示
已知M物质和氯化钠的溶解度与温度的关系如表所示| 温度/℃ | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | 物质M | 32.2 | 37.4 | 40.4 | 50.4 | 55.2 |
| 氯化钠(NaCl) | 35.7 | 35.8 | 36 | 36.3 | 36.6 | |
(2)从表中数据中选择,25℃时,M物质的溶解度应不低于24.4%
(3)根据表分析,若要在某一温度下,分别配制溶质质量分数相等的M和NaCl饱和溶液,则该温度所在的范围是20~30℃
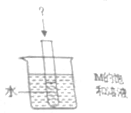
(4)如图,烧杯中盛放着30℃的M的饱和溶液,试管中有适量水,向试管中加入一种固体,过一会儿烧杯底部都有少量M的晶体析出,则试管中加入的固体可能是ACD(填字母)
A.冰块 B.氯化钠 C.干冰 D.硝酸铵 E.氢氧化钠
(5)M物质与下列物质混合(两者之间不发生化学反应),能用溶解、过滤、蒸发的方法分液的是AC(填字母) A.碳酸钙 B.食盐 C.铁粉 D.硝酸钾
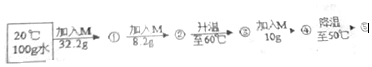
(6)向100g水中不断加入固体M或改变温度,得到如图所示的相应的溶液①②③④⑤这些溶液中为饱和溶液的是①②⑤(填序号)
分析 (1)根据图表数据可知氯化钠的溶解度受温度影响情况;
(2)根据20℃时M的溶解度及溶质的质量分数计算式分析解答;
(3)根据饱和溶液中溶质的质量分数=$\frac{溶解度}{100g+溶解度}$×100%,及图表二者的溶解度分析解答.
(4)根据溶液为饱和溶液以及M物质的溶解度随温度的升高而增大进行解答;
(5)根据过滤适用于不溶性固体物质的分离进行解答.
(6)并根据饱和溶液的定义及M在不同温度下的溶解度判断溶液的状态.
解答 解:(1)由图表数据可知氯化钠的溶解度受温度影响小;
(2)溶液①是在20℃时向100水中加入M32.2g,通过图表可知20℃时M的溶解度是32.2g,说明此时形成的溶液恰好是饱和溶液,溶质M的质量分数是$\frac{32.2g}{132.2g}$×100%≈24.4%;
(3)依据上表信息,当温度在20℃~30℃这一范围时,二者的溶解度可能相同,可在同一温度下,配制出溶质质量分数相等的M和NaCl的饱和溶液;
(4)根据题意:烧杯中盛放着30℃的M的饱和溶液,试管中有适量水,向试管中加入一种固体,过一会儿烧杯底部有少量M的晶体析出,说明M的溶解度减小;观察图表可知:M的溶解度随温度的升高而增大,说明在试管中加入的物质溶解吸热,使溶液温度降低,溶解度减小;分析选项,试管中加入冰块、干冰和硝酸铵可使溶液温度降低,氯化钠溶于水溶液温度变化不大,氧化钙和氢氧化钠溶于水使溶液的温度升高,故选ACD;
(5)过滤适用于不溶性固体物质的分离,碳酸钙和铁粉不溶于水,能用溶解、过滤、蒸发的方法分离.
(6)20℃时M的溶解度是32.2g,20℃时向100水中加入M32.2g恰好饱和,所以溶液①②均为饱和溶液;60℃时M的溶解度是55.2g,而加入溶质的质量是32.2g+8.2g=40.4g,所以③是不饱和溶液;再加入10g,溶质为50.4g,故④依然不饱和,50℃时M的溶解度是50.4g,所以降温至50℃时溶液恰好饱和;
故答案为:(1)小;
(2)24.4%;
(3)20~30;
(4)ACD;
(5)AC;
(6)①②⑤;
点评 本题较为综合的考查了学生对溶解度含义的理解应用、根据图表获取信息,并据饱和溶液、不饱和溶液分析解答,及对溶质质量分数的掌握和解决问题的能力.

 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案| A. | 泡沫塑料、海绵是可燃物 | |
| B. | 泡沫塑料、海绵的着火点很高 | |
| C. | 燃烧产生的浓烟中含有大量有毒气体 | |
| D. | 着火时应尽快湿布捂住口鼻,撤向安全处 |
| A. | 厨房内煤气泄漏打开排气扇通风 | B. | 冬天用煤取暖时封闭门窗 | ||
| C. | 在煤窑中挖煤用火把照明 | D. | 油锅中的油着火用锅盖盖灭 |
【演示实验】将一定量的稀H2SO4加入到盛有NaOH溶液的小烧杯中.在老师引导下,学生写出该反应的化学方程式H2SO4+2NaOH=Na2SO4+2H2O
【提出问题】反应后溶液酸碱性如何?同学们,有猜酸性,有猜碱性,还有猜中性.老师说:实验中未观察到明显现象,应该先从反应后溶液中溶质进行分析.
针对反应后溶液的溶质成分,甲组同学的猜想如下.
【假设猜想】:猜想一:只有Na2SO4猜想二:有Na2SO4和H2SO4
猜想三:有Na2SO4和NaOH猜想四:有Na2SO4、H2SO4和NaOH
乙组同学对以上猜想提出质疑,认为不合理的猜想是猜想四.理由是H2SO4和NaOH在溶液中不能共存.
【实验探究】(1)丙组同学取烧杯中的溶液少量于试管中,滴加几滴酚酞溶液,无明显变化.认定溶液中一定没有NaOH.
(2)为了验证其余猜想,各学习小组利用烧杯中的溶液,并选用老师提供的pH试纸、铜片、BaCl2溶液、Na2CO3溶液,进行如下三个方案的探究.已知BaCl2与Na2SO4和H2SO4均能反应,方程式为:BaCl2+Na2SO4═BaSO4↓+2NaCl,BaCl2+H2SO4═BaSO4═BaSO4↓+2HCl
| 实验方案 | A 测溶液pH | B滴加Na2CO3溶液 | C滴加BaCl2溶液 |
| 实验操作 | 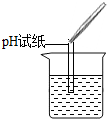 | 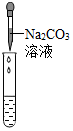 |  |
| 实验现象 | 试纸变色,对比比色卡,pH<7 | 产生有气泡产生 | 产生白色沉淀 |
| 实验结论 | 溶液显酸性 | 溶液中有H2SO4剩余 | 溶液中有H2SO4剩余 |
【评价反思】老帅对同学们能用多种方法进行探究并且得出正确结论给予肯定.但同时指出:在【实验探究】(2)中存在两处明显错误,请大家反思.同学们经过反思发现了这两处错误:第一,实验操作中的错误是pH试纸浸入溶液中.第二,实验方案高计错误的是Na2SO4与BaCl2反应也会生成白色沉淀,不能证明一定有H2SO4存在.(填字母)
| A. | 汽油挥发 | B. | 水的电解 | C. | 胆矾研碎 | D. | 干冰升华 |
| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | |
| 溶解度/g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 | 169 |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 | 37.8 | 38.4 | |

(1)依据上表数据,绘制出KNO3和NaCl的溶解度曲线,图1中能表示NaCl溶解度曲线的是n(填m或n);
(2)如图2所示,20℃时,将盛有饱和KNO3溶液的小试管放入盛水的烧杯中,向水中加入某物质后,试管中有晶体析出,加入的物质可能是下列中CD(填字母序号)
A.氢氧化钠固体 B.生石灰固体 C.冰块 D.硝酸铵固体
(3)“配制40g质量分数为5%的氯化钠溶液”时,实验的部分操作如图3所示.
①称量时A出现了右盘低的现象,接下来的操作应该是D(填序号)
A.左边的平衡螺丝向左侧 B.右边的平衡螺丝向右调
C.右盘中减少砝码 D.左盘中增加食盐
②量取水时,如果按照图B的方法读数,会使配制的溶液溶质质量分数偏小(填“偏大”或“偏小”)
③C中用玻璃棒搅拌的作用是加速溶解,若配制过程中,在已经有少量水的烧杯中加入氯化钠和水,其他操作均规范,则所得溶液中氯化钠的质量分数<(填“>”或“<”或“=”)5%.
④D中所贴标签有不妥之处,请划掉不妥的地方,并在方框中写出你认为适合的内容.

 现有铜粉和镁粉的混合物样品,某兴趣小组要测定样品中镁的质量分数.他们称取该混合物样品10g置于烧杯中,然后加入350g一定质量分数的稀盐酸.所加稀盐酸的质量与产生氢气的质量关系如图所示.请计算:
现有铜粉和镁粉的混合物样品,某兴趣小组要测定样品中镁的质量分数.他们称取该混合物样品10g置于烧杯中,然后加入350g一定质量分数的稀盐酸.所加稀盐酸的质量与产生氢气的质量关系如图所示.请计算: