题目内容
11.下列反应属于复分解反应的是( )| A. |  | B. |  | ||
| C. |  | D. |  |
分析 根据两种化合物通过交换成分生成另外两种化合物的复分解反应的定义,利用复分解反应为两化合物相互交换成分而发生反应的特点,判断反应为复分解反应.
解答 解:
A、由微观模型图可以看出:是由一种单质和一种化合物反应,生成另一种单质和另一种化合物,属于置换反应,故错;
B、由微观模型图可以看出:属于两化合物交换成分生成两化合物的复分解反应;故对;
C、由微观模型图可以看出:属于两种物质生成一种物质的化合反应,故错;
D、由微观模型图可以看出:属于一种物质水生成两种物质的分解反应;故错;
答案:B
点评 熟练掌握常见物质的反应是解决本问题的基础,根据常见物质所发生反应的特点,完成对反应类型的判断.

练习册系列答案
相关题目
1. (1)如图是a、b、c三种物质溶解度曲线,a与c溶解度曲线相交于P点.据图回答:①P点的含义是当温度为t1℃时,a与c的溶解度相等.
(1)如图是a、b、c三种物质溶解度曲线,a与c溶解度曲线相交于P点.据图回答:①P点的含义是当温度为t1℃时,a与c的溶解度相等.
②t2℃时30g a物质加入到50g水中不断搅拌,形成溶液质量是75g.
③将t2℃时a、b、c三种物质饱和溶液的温度降到t1℃时,三种溶液中溶质的质量分数由大到小的顺序排列是b>a>c
(2)KNO3和KCl在不同温度时的溶解度如下表所示:
由表中数据分析可知,KNO3和KCl在某一温度时具有相同的溶解度x,则x的取值最小范围是34g<x<37g.
 (1)如图是a、b、c三种物质溶解度曲线,a与c溶解度曲线相交于P点.据图回答:①P点的含义是当温度为t1℃时,a与c的溶解度相等.
(1)如图是a、b、c三种物质溶解度曲线,a与c溶解度曲线相交于P点.据图回答:①P点的含义是当温度为t1℃时,a与c的溶解度相等.②t2℃时30g a物质加入到50g水中不断搅拌,形成溶液质量是75g.
③将t2℃时a、b、c三种物质饱和溶液的温度降到t1℃时,三种溶液中溶质的质量分数由大到小的顺序排列是b>a>c
(2)KNO3和KCl在不同温度时的溶解度如下表所示:
| /℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | |
| /g | KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | 138 |
| KCl | 27.6 | 31.0 | 34.0 | 37.0 | 40.0 | 42.6 | 45.5 | 48.3 | |
2.下列各组微粒中,各微粒具有相同电子数的一组是( )
| A. | Na、Mg2+、Al3+ | B. | HF、OH -、NH4+ | C. | S、Cl-、Ar | D. | CH4、NH3、H2S |
19.在一定条件下,木炭、一氧化碳、氢气都能与氧化铜发生反应,下列对这三个反应的分析,正确的是( )
| A. | 所发生的反应都是置换反应 | |
| B. | 反应后都能生成二氧化碳气体 | |
| C. | 反应后都能生成红色的固体 | |
| D. | 反应前后各元素的化合价都发生了变化 |
6.运载浓硫酸的卡车在公路上侧翻,装酸罐破裂,酸到处泄露.为了尽量减轻浓硫酸对周边环境的影响,下列措施不合理的是( )
| A. | 将熟石灰洒在浓硫酸上 | B. | 用生石灰掩埋浓硫酸 | ||
| C. | 将纯碱洒在浓硫酸上 | D. | 用大量的水稀释浓硫酸 |
16.纯碱是重要的化工原料.
制备探究:如图是工业生产纯碱的主要流程示意图.

【查阅资料】
①粗盐水中含有杂质MgCl2、CaCl2;
②常温下,NH3极易溶于水,CO2能溶于水,
③NaHCO3加热易分解,Na2CO3加热不易分解.
(1)写出除去粗盐水中MgCl2的化学方程式:MgCl2+2NaOH═Mg(OH)2↓+2NaCl.
(2)在工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是使溶液显碱性,更多的吸收二氧化碳,“碳酸化”时,NaCl、NH3、CO2 和H2O相互作用析出NaHCO3,写出该反应的化学方程式NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl.
(3)煅烧制得纯碱的化学方程式是2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
(4)某海洋化工集团生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验:取11.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,在把100g稀盐酸平均分成四份依次放入样品中,每次均充分反应,实验数据记录如下:
请你据此分析计算:
①第一次加入盐酸充分反应后,生成二氧化碳的质量是1.8g.
②该产品中碳酸钠的质量分数是否合格?(写出计算过程,结果精确到0.1%)
制备探究:如图是工业生产纯碱的主要流程示意图.

【查阅资料】
①粗盐水中含有杂质MgCl2、CaCl2;
②常温下,NH3极易溶于水,CO2能溶于水,
③NaHCO3加热易分解,Na2CO3加热不易分解.
(1)写出除去粗盐水中MgCl2的化学方程式:MgCl2+2NaOH═Mg(OH)2↓+2NaCl.
(2)在工业生产纯碱工艺流程中,先“氨化”后“碳酸化”的目的是使溶液显碱性,更多的吸收二氧化碳,“碳酸化”时,NaCl、NH3、CO2 和H2O相互作用析出NaHCO3,写出该反应的化学方程式NaCl+NH3+CO2+H2O=NaHCO3+NH4Cl.
(3)煅烧制得纯碱的化学方程式是2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+H2O+CO2↑
(4)某海洋化工集团生产的纯碱产品中含有少量氯化钠杂质,其产品包装袋上注明:碳酸钠≥96%.为测定该产品中含碳酸钠的质量分数,进行了以下实验:取11.0g纯碱样品放入烧杯中,称得烧杯及所盛纯碱样品的总质量为158.0g,在把100g稀盐酸平均分成四份依次放入样品中,每次均充分反应,实验数据记录如下:
| 所加盐酸的次数 | 第一次 | 第二次 | 第三次 | 第四次 |
| 盐酸的质量/g | 25 | 25 | 25 | 25 |
| 烧杯及所盛物质总质量/g | 181.2 | 204.4 | 228.6 | 253.6 |
①第一次加入盐酸充分反应后,生成二氧化碳的质量是1.8g.
②该产品中碳酸钠的质量分数是否合格?(写出计算过程,结果精确到0.1%)
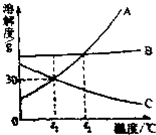 如图是A、B、C三种物质的溶解度曲线.看图回答问题:
如图是A、B、C三种物质的溶解度曲线.看图回答问题: ”表示氧原子,“
”表示氧原子,“ ”表示氢原子)
”表示氢原子)