题目内容
8.学习化学后,同学们对课本上“在金属的活动性顺序里,位于前面的金属能把位于后面的金属从它们的化合物的溶液中置换出来”以及“支持燃烧的气体一般是氧气”这两句话产生了质疑.在老师的帮助下,用金属钠来探究下列问题:【提出问题】
1、金属钠能否置换出硫酸铜溶液中的铜?
2、金属钠能否在其他气体(如:CO2)中燃烧?
【查阅资料】金属Na性质活泼,常温下,它极易与氧气反应生成白色固体氧化钠,氧化钠溶于水生成氢氧化钠.金属钠还可以与水剧烈反应放出氢气.
【实验探究】
实验一:①在实验室中,金属钠保存在煤油中;
②用镊子从煤油中取出一小块金属钠,用滤纸吸干表面煤油后投入硫酸铜溶液中,观察到溶液中出现蓝色沉淀,但没有红色的物质析出;
③按照步骤②将金属钠投入水中,待反应结束后滴加酚酞溶液,发现溶液变红.
实验二:将燃烧的钠迅速伸入盛有CO2的集气瓶中,观察到钠在CO2中继续燃烧,反应后冷却,瓶内附着黑色颗粒,并粘附着白色物质.
【问题讨论】
(1)金属钠保存在煤油中的原因是:防止钠与氧气反应变质.
(2)实验一中将钠投入到硫酸铜溶液中出现的蓝色沉淀是Cu(OH)2(填化学式).
(3)写出钠块投入水中发生反应的化学方程式:2Na+2H2O═2NaOH+H2↑.
(4)实验二中生成的黑色颗粒是碳,而白色物质可能是什么呢?
①同学们围绕白色物质可能是什么产生如下猜想:甲认为白色物质是氧化钠,乙认为是碳酸钠,丙认为是氧化钠和碳酸钠的混合物,丁认为是氢氧化钠.
我认为丁的猜想是错误的,理由是反应物中没有氢元素.
②对白色物质是什么进行实验再探究,方案设计如下:
方案1:取该样品少量于试管里,加入适量的水,振荡,过滤,向滤液中加入无色酚酞试液,观察到溶液变成红色,结论:白色物质中一定有氧化钠.
方案2:取该样品少量于试管里,滴加足量盐酸,溶液中有气泡冒出,结论:白色物质中一定有碳酸钠.
③评价与反思:小娟同学认为实验方案1得出的结论不正确,其理由是碳酸钠溶液也是碱性的;
【拓展应用】测定实验中使用的标有质量分数为16%的盐酸(图1)的实际质量分数.
为了测定盐酸实际的质量分数,小明先配制了20%的氢氧化钠溶液100g,然后在烧杯中加入一定量配好的氢氧化钠溶液,再逐滴加入该盐酸,恰好完全反应时测得烧杯内剩余物总量为45g.整个实验过程用pH测定仪测定滴加过程中溶液的pH.图2为测定仪打印出的滴加盐酸的质量与溶液pH的关系图.
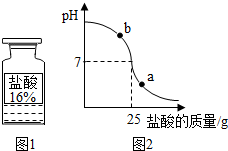
请以此次测定的数据,列式计算该盐酸的实际质量分数?(写出完整的计算过程!!!)
(3)该盐酸的实际质量分数与标签上标出的质量分数不一致的可能原因盐酸具有挥发性.
分析 (1)根据金属钠的化学性质非常活泼,易与氧气和水发生化学反应分析;
(2)根据实验一种将钠投入到硫酸铜溶液中出现的蓝色沉淀是氢氧化铜解答;
(3)金属钠投入硫酸铜溶液中,根据酚酞试液变红及元素守恒的角度分析钠与水反应的产物并写出方程式;
(4)①根据金属钠也能在二氧化碳中燃烧,根据质量守恒定律中化学反应前后元素的种类不变分析黑色固体的成分和白色物质的成分;
方案2:依据滴加足量盐酸,溶液中有气泡冒出,推测白色物质的成分;
③评价与反思 根据碳酸钠也显碱性分析;
【拓展应用】观察图示,当滴加盐酸到C点时,溶液的pH=7,25g的盐酸与20g20%的氢氧化钠溶液恰好完全反应,根据盐酸与氢氧化钠的反应,由氢氧化钠的质量求出所消耗的盐酸中溶质的质量;再根据溶质质量分数的公式计算该盐酸的实际质量分数;
(3)根据盐酸的挥发性分析.
解答 解:(1)金属Na性质活泼,常温下极易与氧气反应生成白色固体氧化钠,氧化钠溶于水生成氢氧化钠;金属钠还可以与水剧烈反应放出氢气,因此保存在煤油中.
故答案为:防止钠与氧气和水反应变质;
(2)将金属钠投入水中,待反应结束后滴加酚酞溶液,发现溶液变红,说明产生了碱性的物质,根据反应前后元素的种类不变,因此是氢氧化钠;氢氧化钠与硫酸铜溶液反应生成氢氧化铜蓝色沉淀;故实验一种将钠投入到硫酸铜溶液中出现的蓝色沉淀是Cu(OH)2.
(3)将金属钠投入水中,待反应结束后滴加酚酞溶液,发现溶液变红,说明产生了碱性的物质,根据反应前后元素的种类不变,因此是氢氧化钠;结合资料提供的还产生氢气,因此氧气还能和水反应生成氢氧化钠和氢气;
故答案为:2Na+2H2O=2NaOH+H2↑;
(4)①根据质量守恒定律化学反应前后元素的种类不变可知:二氧化碳和金属钠反应生成了黑色的物质应该是碳和白色的物质不可能是氢氧化钠,因为反应物中无氢元素,因此不可能是氢氧化钠;
方案2:因为滴加足量盐酸,溶液中有气泡冒出,可证明有碳酸钠.
③评价与反思 向滤液中加入无色酚酞试液,观察到溶液变成红色,不能说明白色物质中一定有氧化钠,因为碳酸钠也显碱性;
【拓展应用】
设:此盐酸的质量分数为x
NaOH+HCl=NaCl+H2O
40 36.5
20g×20% 25g×x
$\frac{40}{20g×20%}=\frac{36.5}{25g×x}$
x=14.6%
答:此待测盐酸质量分数为14.6%
(3)盐酸具有挥发性,是导致盐酸溶液溶质质量分数减少的原因;
故答案为:盐酸具有挥发性.
答案:
【问题讨论】
(1)防止钠与氧气反应变质,
(2)Cu(OH)2;
(3)2Na+2H2O═2NaOH+H2↑;
(4)碳(或C);
①反应物中没有氢元素; ②碳酸钠(或Na2CO3); ③碳酸钠溶液也是碱性的;
【拓展应用】此待测盐酸质量分数为14.6%;
(3)盐酸具有挥发性.
点评 本考点属于信息给与题,在主要考查了金属钠的物理性质和化学性质,以及氧气、水和二氧化碳与钠反应的有关性质和反应的类型.还考查了质量守恒定律中,元素的种类反应前后不变,并设计实验,进行探究,能够激发学生的探究欲望,综合性比较强.

| A. | 先偏向左边,最后平衡 | B. | 先偏向左边,最后偏向右边 | ||
| C. | 一直平衡 | D. | 先偏向右边,最后偏向左边 |
| A. | 原子是由原子核和核外电子构成的 | B. | 分子是保持物质性质的微粒 | ||
| C. | 原子是不能再分的微粒 | D. | 离子不一定带有电荷 |

 为判断某物质存在或某物质恰好完全反应,通常以特定物质的显色达到目,能显色的物质就称“指示剂”.如:用蓝色的石蕊试纸变红判断待测液显酸性;用淀粉溶液变蓝判断单质碘(I2)的存在
为判断某物质存在或某物质恰好完全反应,通常以特定物质的显色达到目,能显色的物质就称“指示剂”.如:用蓝色的石蕊试纸变红判断待测液显酸性;用淀粉溶液变蓝判断单质碘(I2)的存在