题目内容
1.将一定质量的锌粉加入到硝酸铜和硝酸银的混合溶液中,充分反应后过滤.下列分析正确的是AA、滤渣可能是铜和银 B、滤渣中一定没有锌
C、滤渣中一定没有银离子 D、如果滤液为无色,则滤液中的阳离子为Zn2+.
分析 在金属活动性顺序中,氢前的金属能与酸反应生成氢气,位置在前的金属能将位于其后的金属从其盐溶液中置换出来.据此分析判断.
解答 解:锌、铜、银三种金属的活动性顺序是:锌>铜>银,将一定质量的锌粉加入到硝酸铜和硝酸银的混合溶液中,锌先与硝酸银反应生成了银和硝酸锌,当硝酸银反应完全后锌再与硝酸铜反应生成了硝酸锌和铜.所以:
A、若锌的量不足,只能将铜部分置换出来,则滤渣中含有铜和银,故A正确;
B、若锌过量,则滤渣中才含有锌,故B错误;
C、若锌的量不足,不能将溶液的银全部置换出,滤渣中就含有银离子,故C错误;
D、如果滤液为无色,则滤液中一定不含有Cu2+,则也一定无Ag+,故滤液中的阳离子为Zn2+.
故答为:A,Zn2+.
点评 本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
10.下列物品中,由有机合成材料制成的是( )
| A. | 陶瓷碗 | B. | 玻璃杯 | C. | 塑料瓶 | D. | 竹筷子 |
11. 如图是某物质的分子模型图,下列有关说法错误的是( )
如图是某物质的分子模型图,下列有关说法错误的是( )
 如图是某物质的分子模型图,下列有关说法错误的是( )
如图是某物质的分子模型图,下列有关说法错误的是( )| A. | 该物质的化学式可表示为C2H6 | |
| B. | 该物质的一个分子中含有8个原子 | |
| C. | 该物质是由碳、氢两种元素组成的 | |
| D. | 该物质中碳、氢两种元素的质量比为1:3 |
8.常见的物质中,不属于混合物的是( )
| A. | 矿泉水 | B. | 洁净的空气 | C. | 干冰 | D. | 加碘食盐 |
15.根据下面的实验过程和提供的数据,回答下列问题.

(1)生成氢气的物质的量0.1mol.
(2)通过化学方程式计算混合物中铁粉的质量分数.(计算结果精确到0.1%)
(3)过滤后溶液的质量为55.4g.

(1)生成氢气的物质的量0.1mol.
(2)通过化学方程式计算混合物中铁粉的质量分数.(计算结果精确到0.1%)
(3)过滤后溶液的质量为55.4g.
6.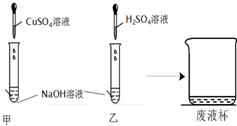 甲、乙两同学在学完酸、碱、盐的化学性质后,做了如下实验:
甲、乙两同学在学完酸、碱、盐的化学性质后,做了如下实验:
(1)乙中反应的化学方程式为2NaOH+H2SO4=Na2SO4+2H2O;
(2)甲、乙同学实验结束后把试管中的物质倒入一个干净的烧杯中(如图所示),混合后观察到烧杯中有蓝色沉淀,其化学式为Cu(OH)2.大家把烧杯中的混合物进行过滤,对滤液中溶质的组成进行了实验探究.
【猜想】
猜想①:溶质有Na2SO4和CuSO4
猜想 ②:溶质有Na2SO4和NaOH
猜想 ③:溶质有Na2SO4和H2SO4
你的猜想是Na2SO4 CuSO4、NaOH
【讨论】大家认为猜想③不正确,理由是生成氢氧化铜蓝色沉淀,证明溶液不显酸性,即不可能有硫酸剩余.;
【实验】
【反思】若将化学实验后的废液直接倒入下水道,造成的危害有下水道的铁制管道被腐蚀,同时造成水质被污染,不利于环境保护.
 甲、乙两同学在学完酸、碱、盐的化学性质后,做了如下实验:
甲、乙两同学在学完酸、碱、盐的化学性质后,做了如下实验:(1)乙中反应的化学方程式为2NaOH+H2SO4=Na2SO4+2H2O;
(2)甲、乙同学实验结束后把试管中的物质倒入一个干净的烧杯中(如图所示),混合后观察到烧杯中有蓝色沉淀,其化学式为Cu(OH)2.大家把烧杯中的混合物进行过滤,对滤液中溶质的组成进行了实验探究.
【猜想】
猜想①:溶质有Na2SO4和CuSO4
猜想 ②:溶质有Na2SO4和NaOH
猜想 ③:溶质有Na2SO4和H2SO4
你的猜想是Na2SO4 CuSO4、NaOH
【讨论】大家认为猜想③不正确,理由是生成氢氧化铜蓝色沉淀,证明溶液不显酸性,即不可能有硫酸剩余.;
【实验】
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量滤液于试管中,向其 滴加无色酚酞溶液,振荡 | 溶液由无色 变为红色 | 猜想②正确 |