题目内容
11.工业烧碱中常含有杂质碳酸钠.某兴趣小组同学围绕工业烧碱样品纯度测定问题,展开了讨论与探究.【实验思路】利用Na2CO3与稀H2SO4反应产生CO2,通过测定产生的CO2质量,确定样品中碳酸钠的质量,计算样品纯度.
【实验方案】小明根据以上思路,设计了如图甲的实验方案(固定装置省略).
(1)A中发生的化学反应方程式有Na2CO3+H2SO4=Na2SO4+H2O+CO2↑、H2SO4+2NaOH═Na2SO4+2H2O.
(2)浓硫酸的作用为吸水干燥二氧化碳气体.
(3)能说明样品中的碳酸钠完全反应的现象是继续滴加稀硫酸时,不再有气泡产生.
【交流讨论】经讨论,小组同学一致认为图甲中小明设计的实验方案有缺陷,则因方案设计缺陷而导致误差的因素有②③④(填序号).
①加入的稀硫酸量不足 ②装置内空气中的CO2没有排出
③反应产生的CO2未被完全吸收 ④干燥管与空气直接相通
【实验改进】为减少误差,使测定生成CO2的质量更准确,该小组同学根据以上讨论,对图甲方案进行改进,设计了如图乙的实验方案(固定装置省略).
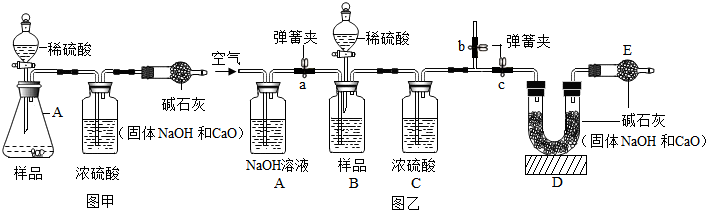
图乙B装置中样品在与稀硫酸反应前和停止反应后,都要通过量的空气,反应前通空气时a、b、c三个弹簧夹的控制方法是先关闭c,再打开a、b.
【数据分析】该实验测定工业烧碱的纯度,需要收集的数据有样品的质量和D装置增加的质量,若撤去图乙中的A装置,实验步骤同上,则测得工业烧碱的纯度将偏低(填“偏高”、“偏低”或“无影响”).
【实验反思】有同学认为也可用“沉淀法”来测定上述工业烧碱样品的纯度,可供选择的试剂有氯化钙溶液、氯化钡溶液,你认为选择哪种试剂更好,并简述理由:选BaCl2溶液更好.与等质量的碳酸钠反应,BaCl2反应后生成的沉淀质量更大,称量时误差小,计算结果更准确.
【拓展提高】已知Na2CO3溶液滴加稀硫酸并不断振荡,先生成NaHCO3,当Na2CO3全部转化为NaHCO3后,生成的NaHCO3能继续与稀硫酸反应生成CO2.现向样品中加一定量的稀硫酸,反应后产生无色气体并得到X溶液.请分析推断反应后所得X溶液的溶质,其所有的可能组成情况为①Na2SO4和H2SO4;②Na2SO4;③Na2SO4和NaHCO3.
分析 【实验方案】考虑A中碳酸钠与稀硫酸反应;考虑浓硫酸的作用;
【交流讨论】通过分液漏斗可以随时向锥形瓶中加入稀硫酸;装置内空气中的CO2没有排出,反应产生的CO2未被完全吸收,干燥管与空气直接相通等都会影响实验结果;
【方案改进】样品在与稀硫酸反应前通过量的除去二氧化碳的空气,是为了把装置中的二氧化碳排出;
停止反应后,通过量的除去二氧化碳的空气,是为了使反应生成的二氧化碳全部被碱石灰吸收;
【数据分析】撤去图乙中的A装置,考虑空气中二氧化碳会进入碱石灰中,并且被吸收,会影响实验结果.
【实验反思】考虑:与等质量的碳酸钠反应,BaCl2反应后生成的沉淀质量更大,称量时误差小,计算结果更准确.
【拓展提高】根据题给的信息结合硫酸和碳酸钠反应进行分析.
解答 解:
【实验方案】(1)根据图可知A中发生的化学反应为碳酸钠与稀硫酸反应、稀硫酸与氢氧化钠溶液反应,其化学方程式分别为:Na2CO3+H2SO4=Na2SO4+H2O+CO2↑、H2SO4+2NaOH═Na2SO4+2H2O.
(2)浓硫酸的作用为吸水干燥二氧化碳气体.
(3)能说明样品中的碳酸钠完全反应的现象是继续滴加稀硫酸时,不再有气泡产生.
【交流讨论】经讨论,小组同学一致认为图甲中小明设计的实验方案有缺陷,则因方案设计缺陷而导致误差的因素有:装置内空气中的CO2没有排出;反应产生的CO2未被完全吸收;干燥管与空气直接相通.
【实验改进】图乙B装置中样品在与稀硫酸反应前和停止反应后,都要通过量的空气,反应前通空气时a、b、c三个弹簧夹的控制方法是先关闭c,再打开a、b.
【数据分析】该实验测定工业烧碱的纯度,需要收集的数据有样品的质量和D装置增加的质量,若撤去图乙中的A装置,实验步骤同上,空气中二氧化碳会进入碱石灰中,并且被吸收,则测得工业烧碱的纯度将偏低.
【实验反思】有同学认为也可用“沉淀法”来测定上述工业烧碱样品的纯度,可供选择的试剂有氯化钙溶液、氯化钡溶液,则:选BaCl2溶液更好.与等质量的碳酸钠反应,BaCl2反应后生成的沉淀质量更大,称量时误差小,计算结果更准确.
【拓展提高】硫酸和碳酸钠反应生成了硫酸钠、水和二氧化碳,若硫酸和碳酸钠恰好完全反应则生成的溶液中的溶质为硫酸钠;若硫酸过量,则得到溶液溶质为硫酸钠和硫酸,若硫酸的量不足,则得到溶液含有的溶质为硫酸钠和碳酸氢钠.
故答案为:
(1)Na2CO3+H2SO4═Na2SO4+H2O+CO2↑,H2SO4+2NaOH═Na2SO4+2H2O;
(2)吸水干燥CO2气体;(3)继续滴加稀硫酸时,不再有气泡产生;
【交流讨论】②③④;
【方案改进】先关闭c,再打开a、b;
【数据分析】样品的质量和D装置增加的质量;偏低;
【实验反思】选BaCl2溶液更好.与等质量的碳酸钠反应,BaCl2反应后生成的沉淀质量更大,称量时误差小,计算结果更准确.
【拓展提高】①Na2SO4和H2SO4;②Na2SO4;③Na2SO4和NaHCO3.
点评 在解此类题时,首先分析问题情景,找到实验探究的反应原理;再根据实验的反应原理,分析推断出该物质的组成成分,然后得出所要探究的物质中该成分的组成.

| 清洁产品 | 除垢净 | 去污粉 | 管道通 |
| 主要成分 | 盐酸 | 碳酸钠 | 氢氧化钠、铝粉 |
(2)去污粉与除垢净不能混合使用,其原因是Na2CO3+2HCl═2NaCl+CO2↑+H2O(用化学方程式表示).
(3)管道通使用时不能接触皮肤,原因是NaOH具有强烈的腐蚀性.使用时利用Al与NaOH溶液反应放出大量的热,以加快NaOH与淤积物的作用,该反应的化学方程式为2Al+2NaOH+2H2O═2NaAlO2+3H2↑,其中铝元素的化合价变化为0~+3.
| 实验操作(可用文字叙述,也可用图示) | 实验现象 |
| 选项 | 物质(括号内为杂质) | 杂质 | 除杂的试剂和方法 |
| A | NaOH溶液(Na2SO4) | 过量的Ba(OH)2溶液 | 过滤 |
| B | KCl(MnO2) | 水 | 溶解、过滤、洗涤干燥 |
| C | CO(CO2) | 足量氢氧化钠溶液 | 通入并干燥 |
| D | NaCl溶液(Na2CO3) | 足量稀盐酸 | 蒸发 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 氮气用作食品的保护气 | B. | 氧气用于急救病人 | ||
| C. | 活性炭用于冰箱除味剂 | D. | 熟石灰用于改良酸性土壤 |

