题目内容
15.空气中氮气的含量最多,氮气在高温、高能量条件下可与某些物质发生反应.图1是以空气和其它必要的原料合成化肥NH4NO3的工业流程.请按要求回答下列问题:
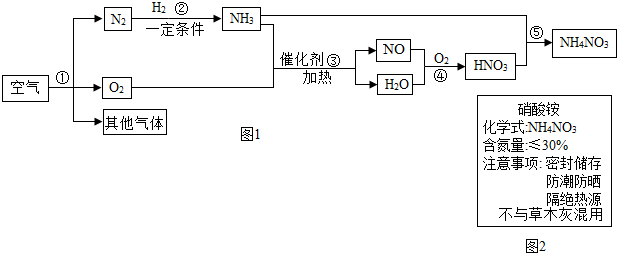
(1)步骤①中发生的是物理变化(选填“物理”或“化学”).
(2)写出步骤③中发生反应的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(3)图2标签所标注的“含氮量≤30%”是否合理否(选填“是”或“否”).
(4)硝酸铵属于氮肥(填写化肥类别).分析图2标签上的信息,可得出硝酸铵具有的性质是ACD(选填字母).
A.易溶于水 B.有挥发性 C.受热易分解 D.能与熟石灰发生反应.
分析 (1)根据分离液态空气法获得气体的变化特征分析;
(2)根据步骤③是氨气和氧气在催化剂加热的条件下生成一氧化氮和水进行分析;
(3)根据硝酸铵中氮元素的质量分数分析判断.
(4)根据硝酸铵中含有的农作物所需要的营养元素和保存方法分析判断.
解答 解:(1)从空气中分离出原有的氮气和氧气是利用二者的沸点不同,没有产生新的物质,发生的是物理变化;
(2)步骤③是氨气和氧气在催化剂加热的条件下生成一氧化氮和水,化学方程式为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;
(3)硝酸铵中氮元素的质量分数数:$\frac{14×2}{80}×100%$=35%,所以,图2标签所标注的“含氮量≤30%”不合理.
(4)硝酸铵中含有的农作物所需要的营养元素氮元素,属于氮肥;由图2标签上的信息“防潮防晒”、“隔绝热源”可知,NH4NO3易溶于水且受热易分解,不能说明硝酸铵具有挥发性;由“不能与草木灰混用”说明了硝酸铵能与熟石灰发生反应.
故答为:(1)物理;(2)4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O;(3)否,(4)氮,A C D.
点评 本题主要考查了合成硝酸铵的工艺流程及方程式的书写及利用标签信息分析物质的性质,学会根据题目给予的信息来分析题目并结合相关的知识分析问题是正确解答本题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
3.下列变化中,属于化学变化的是( )
| A. | 香水挥发 | B. | 煤的炼焦 | C. | 车胎爆炸 | D. | 干冰升华 |
10.除去下列物质中的少量杂质.所选用的试剂(均过量)及操作方法均正确的是( )
| 选项 | 物质(括号内为杂质) | 试剂 | 操作方法 |
| A | CaO (CaCO3) | -- | 加热到质量不再减少 |
| B | CO2气体(HCl) | 氢氧化钠溶液、浓硫酸 | 洗气、干燥 |
| C | NaCl固体(BaSO4) | 水 | 溶解、过滤、蒸发 |
| D | NaCl固体(MgCl2) | NaOH溶液 | 过滤、蒸发 |
| A. | A | B. | B | C. | C | D. | D |
20.检验一瓶久置的NaOH溶液是否变质,下列所用试剂不正确的是( )
| A. | 稀H2SO4 | B. | 酚酞试液 | C. | BaCl2溶液 | D. | Ca(NO3)2溶液 |
4.一些食物的近似PH如表:
人的胃液中含有盐酸,对于胃酸过多的人,空腹时最宜食用上述食物中的( )
| 食 物 | 苹 果 | 葡 萄 | 牛 奶 | 玉米粥 |
| pH | 2.9-3.3 | 3.5-4.5 | 6.3-6.6 | 6.8-8.0 |
| A. | 苹果 | B. | 葡萄 | C. | 牛奶 | D. | 玉米粥 |
5.某校研究性学习活动小组利用课余时间调查雾霾产生的原因,并提出可减少的雾霾说法正确的是( )
| A. | 鼓励开私家车出行 | B. | 鼓励使用太阳能热水器 | ||
| C. | 鼓励用煤火力发电 | D. | 鼓励露天焚烧垃圾 |
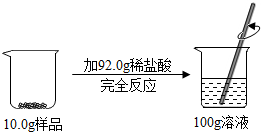 某样品由氧化铜和铜组成,取10.0g该样品于烧杯中,向其中加入92.0g稀盐酸,恰好完全反应,最终所得溶液质量为100.0g.(化学反应方程式为:CuO+2HCl═CuCl2+H2O)
某样品由氧化铜和铜组成,取10.0g该样品于烧杯中,向其中加入92.0g稀盐酸,恰好完全反应,最终所得溶液质量为100.0g.(化学反应方程式为:CuO+2HCl═CuCl2+H2O)