题目内容
16.某化学兴趣小组的同学将足量镁带投入NH4Cl溶液中,发现镁带逐渐溶解的同时有较多的气泡放出,镁能与NH4Cl溶液反应吗?如果能反应,生成物可能是什么?同学们进行下列实验探究:探究1:反应后所得溶液中溶质是什么?
【进行猜想】可能是MgCl2
【实验验证】
| 实验步骤 | 实验现象 | 实验结论 |
| 取反应后溶液少量于试管中,滴入NaOH溶液 | 产生白色沉淀 | 反应后所得溶液中溶质是MgCl2 |
| 另取反应后溶液少量于试管中,滴入硝酸银溶液和稀硝酸. |
【进行猜想】猜想一:可能是NH3;
猜想二:可能是氢气;
猜想三:可能是NH3和H2的混合气体;
【查阅资料】在百度网页中输入氨气的化学性质,可以获知氨气的部分化学性质如下:
①跟谁反应:NH3+H2O═NH3•H2O
②跟酸反应:NH3+HCl═NH4Cl 2NH3+H2SO4═(NH4)2SO4
③跟某些金属氧化物反应:3CuO+2NH3$\frac{\underline{\;△\;}}{\;}$3Cu+3H2O+N2
【实验探究】为了探究气体的成分,同学们设计了如下实验装置:
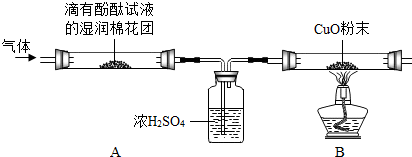
①A中观察到A中棉花团变红色,证明有NH3;
②B中玻璃管内观察到黑色粉末变红色,证明有H2;
③浓硫酸的作用是吸收氨气.
【实验结论】综合以上实验现象和分析,镁与NH4Cl反应的化学方程式为Mg+2NH4Cl=MgCl2+H2↑+2NH3↑.
分析 【实验验证】根据氯离子和银离子反应会生成不溶于硝酸的白色氯化银沉淀进行分析;
【进行猜想】根据质量守恒定律进行分析;
①根据氨气溶于水形成氨水,氨水能使酚酞变红色进行分析;
②根据氢气具有还原性,能使黑色的氧化铜变红色进行分析;
③根据浓硫酸是酸性干燥剂,会与碱性气体反应进行分析;
【实验结论】根据镁和氯化铵反应生成氯化镁、氢气和氨气进行分析.
解答 解:【实验验证】氯离子和银离子反应会生成不溶于硝酸的白色氯化银沉淀,所以
| 实验步骤 | 实验现象 | 实验结论 |
| 取反应后溶液少量于试管中,滴入NaOH溶液 | 产生白色沉淀 | 反应后所得溶液中溶质是MgCl2 |
| 另取反应后溶液少量于试管中,滴入硝酸银和稀硝酸 |
①氨气溶于水形成氨水,氨水能使酚酞变红色,所以A中观察到A中棉花团变红色,证明有NH3;
②氢气具有还原性,能使黑色的氧化铜变红色,所以B中玻璃管内观察到黑色粉末变红色,证明有H2;
③浓硫酸是酸性干燥剂,会与碱性气体反应,所以浓硫酸的作用是吸收氨气;
【实验结论】镁和氯化铵反应生成氯化镁、氢气和氨气,化学方程式为:Mg+2NH4Cl=MgCl2+H2↑+2NH3↑.
故答案为:【实验验证】
| 实验步骤 | 实验现象 | 实验结论 |
| 硝酸银和稀硝酸 |
①A中棉花团变红色;
②黑色粉末变红色;
③吸收氨气;
【实验结论】Mg+2NH4Cl=MgCl2+H2↑+2NH3↑.
点评 在解此类题时,首选分析题中考查的问题,然后结合学过的知识和题中的提示进行解答.

练习册系列答案
 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案
相关题目
12.某学生针对下列四组物质的鉴别,设计了两种方案,其中都合理的是( )
| A | B | C | D | |
| 需区分的物质 | 黄铜和黄金 | 聚乙烯(PE)和聚氯乙烯(PVC) | 锦纶布料和羊毛布料 | NH4NO3和NaOH固体 |
| 第一方案 | 分别取样,观察颜色 | 分别取样,观察颜色 | 分别取样,用手触摸 | 分别取样,加水充分溶解,加氯化铵溶液,加热,观察现象 |
| 第二方案 | 分别取样,在石棉网上高温灼烧,观察现象 | 分别取样,分别点燃,闻燃烧时产生的气味 | 分别取样,点燃,闻气味 | 分别取样,加水,滴加无色酚酞溶液,观察现象 |
| A. | A | B. | B | C. | C | D. | D |
11.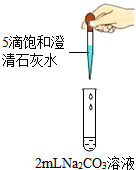 学习酸碱盐知识后,同学们知道碳酸钠溶液与氢氧化钙溶液能发生反应,可观察到溶液变浑浊.甲组同学进行如图1所示的实验,却未观察到预期现象.
学习酸碱盐知识后,同学们知道碳酸钠溶液与氢氧化钙溶液能发生反应,可观察到溶液变浑浊.甲组同学进行如图1所示的实验,却未观察到预期现象.
【提出问题】未观察到浑浊的原因是什么?
【猜想和假设】
①与氢氧化钙溶液的浓度有关.若使用更大浓度的氢氧化钙溶液,会迅速产生浑浊.
②与碳酸钠溶液的浓度有关.若使用更大浓度的碳酸钠溶液,会迅速产生浑浊.
经讨论,同学们认为猜想①不合理,其理由是饱和石灰水已是该温度下质量分数最大的溶液.
【进行实验】乙组同学针对猜想②进行实验.
【解释与结论】
(1)补全上述实验操作:取4支试管,向其中分别加入2mL浓度为10%、5%、1%、0.5%的碳酸钠溶液,再分别滴加5滴饱和石灰水.
(2)氢氧化钙溶液与碳酸钠溶液混合出现浑浊的化学方程式是Ca(OH)2+Na2CO3CaCO3↓+2NaOH.
(3)乙组实验证明:猜想②不成立,碳酸钠溶液浓度在0.5~10%的范围内,能否出现浑浊与碳酸钠溶液的浓度有关,其关系是碳酸钠溶液浓度大,不易产生浑浊.
【实验反思】
(1)丙组同学对乙组所做实验中未出现浑浊的原因进行探究.设计了多组实验,其中部分同学的实验过程及结果如图2

丙组同学的实验目的是探究碳酸钙能否溶解在碳酸钠溶液中.
(2)依据乙、丙两组的实验探究,丁组同学仍使用甲组的仪器和药品对甲组实验进行了改进,当滴入几滴某溶液后,溶液迅速变浑浊.其实验操作是取2mL饱和石灰水于试管中,滴加碳酸钠溶液.
 学习酸碱盐知识后,同学们知道碳酸钠溶液与氢氧化钙溶液能发生反应,可观察到溶液变浑浊.甲组同学进行如图1所示的实验,却未观察到预期现象.
学习酸碱盐知识后,同学们知道碳酸钠溶液与氢氧化钙溶液能发生反应,可观察到溶液变浑浊.甲组同学进行如图1所示的实验,却未观察到预期现象.【提出问题】未观察到浑浊的原因是什么?
【猜想和假设】
①与氢氧化钙溶液的浓度有关.若使用更大浓度的氢氧化钙溶液,会迅速产生浑浊.
②与碳酸钠溶液的浓度有关.若使用更大浓度的碳酸钠溶液,会迅速产生浑浊.
经讨论,同学们认为猜想①不合理,其理由是饱和石灰水已是该温度下质量分数最大的溶液.
【进行实验】乙组同学针对猜想②进行实验.
| 实验目的 | 实验操作 | 实验现象 | |
| 探究猜想② | 取4支试管,向其中分别加入… | 碳酸钠溶液浓度/% | 是否浑浊 |
| 10 | 不浑浊 | ||
| 5 | 不浑浊 | ||
| 1 | 浑浊 | ||
| 0.5 | 浑浊 | ||
(1)补全上述实验操作:取4支试管,向其中分别加入2mL浓度为10%、5%、1%、0.5%的碳酸钠溶液,再分别滴加5滴饱和石灰水.
(2)氢氧化钙溶液与碳酸钠溶液混合出现浑浊的化学方程式是Ca(OH)2+Na2CO3CaCO3↓+2NaOH.
(3)乙组实验证明:猜想②不成立,碳酸钠溶液浓度在0.5~10%的范围内,能否出现浑浊与碳酸钠溶液的浓度有关,其关系是碳酸钠溶液浓度大,不易产生浑浊.
【实验反思】
(1)丙组同学对乙组所做实验中未出现浑浊的原因进行探究.设计了多组实验,其中部分同学的实验过程及结果如图2

丙组同学的实验目的是探究碳酸钙能否溶解在碳酸钠溶液中.
(2)依据乙、丙两组的实验探究,丁组同学仍使用甲组的仪器和药品对甲组实验进行了改进,当滴入几滴某溶液后,溶液迅速变浑浊.其实验操作是取2mL饱和石灰水于试管中,滴加碳酸钠溶液.
5. 某研究性学习小组在探究“锌与硫酸反应快慢的影响因素”时,发现一个意外现象,硫酸中混有硫酸铜溶液时,产生氢气的速率更快.
某研究性学习小组在探究“锌与硫酸反应快慢的影响因素”时,发现一个意外现象,硫酸中混有硫酸铜溶液时,产生氢气的速率更快.
【提出问题】是什么离子导致产生氢气的速率加快?
【猜想假设】他们分别对这种意外现象作如下猜想:
甲同学:可能与铜离子有关;
乙同学:可能与硫酸根离子有关;
丙同学认为乙的猜想不科学,理由是硫酸溶液中本身含有硫酸根离子.
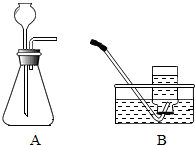
【实验证明】用A、B两组仪器进行实验:
步骤一:检查装置气密性.检查图A所示装置气密性,你采用的方法是连接AB,用拇指堵住导管口,从长颈漏斗加水至一定高度,静置,观察液面不下降,即为气密性良好.
步骤二:量取2份质量分数为20%的稀硫酸各20ml,第一份加入质量分数为10%的稀硫酸铜溶液1ml,第二份加入质量分数为10%的硫酸锌溶液1ml,称取2份形状相同锌粒各1g,分别与以上溶液反应,反应装置如图A所示,用此装置实验时,长颈漏斗下端要插入液面以下,目的是保证气体不从漏斗处逸出,.
实验三:用B收集气体,分别记录收集一瓶气体(集气瓶规格均为125ml)所需的时间(如表),什么时间开始收集气体?等到反应开始产生气体时立刻收集.
锌与硫酸反应的化学方程式是Zn+H2SO4═ZnSO4+H2↑.
【得出结论】硫酸中混有硫酸铜溶液时,产生氢气的速率加快与铜离子有关,实验②中加入质量分数为10%的硫酸锌溶液1ml的作用是加入的硫酸铜溶液对硫酸浓度会产生影响,加入等量的硫酸锌溶液是为了控制硫酸浓度变化对实验数据产生干扰.
【反思质疑】丁同学认为:锌与混有硫酸铜的硫酸溶液反应时,产生氢气的速率较快可能与铜单质有关,他质疑的理由是锌会与硫酸铜反应生成铜.
【继续探究】请你设计一个实验方案验证丁同学的观点是否正确.
 某研究性学习小组在探究“锌与硫酸反应快慢的影响因素”时,发现一个意外现象,硫酸中混有硫酸铜溶液时,产生氢气的速率更快.
某研究性学习小组在探究“锌与硫酸反应快慢的影响因素”时,发现一个意外现象,硫酸中混有硫酸铜溶液时,产生氢气的速率更快.【提出问题】是什么离子导致产生氢气的速率加快?
【猜想假设】他们分别对这种意外现象作如下猜想:
甲同学:可能与铜离子有关;
乙同学:可能与硫酸根离子有关;
丙同学认为乙的猜想不科学,理由是硫酸溶液中本身含有硫酸根离子.
【实验证明】用A、B两组仪器进行实验:
步骤一:检查装置气密性.检查图A所示装置气密性,你采用的方法是连接AB,用拇指堵住导管口,从长颈漏斗加水至一定高度,静置,观察液面不下降,即为气密性良好.
步骤二:量取2份质量分数为20%的稀硫酸各20ml,第一份加入质量分数为10%的稀硫酸铜溶液1ml,第二份加入质量分数为10%的硫酸锌溶液1ml,称取2份形状相同锌粒各1g,分别与以上溶液反应,反应装置如图A所示,用此装置实验时,长颈漏斗下端要插入液面以下,目的是保证气体不从漏斗处逸出,.
实验三:用B收集气体,分别记录收集一瓶气体(集气瓶规格均为125ml)所需的时间(如表),什么时间开始收集气体?等到反应开始产生气体时立刻收集.
| 编号 | 20%的硫酸各20ml | 锌粒 | 收集1瓶氢气所需的时间 |
| ① | 加入质量分数为10%的硫酸铜溶液1ml | 1g | 2分10秒 |
| ② | 加入质量分数为10%的硫酸锌溶液1ml | 1g | 3分01秒 |
【得出结论】硫酸中混有硫酸铜溶液时,产生氢气的速率加快与铜离子有关,实验②中加入质量分数为10%的硫酸锌溶液1ml的作用是加入的硫酸铜溶液对硫酸浓度会产生影响,加入等量的硫酸锌溶液是为了控制硫酸浓度变化对实验数据产生干扰.
【反思质疑】丁同学认为:锌与混有硫酸铜的硫酸溶液反应时,产生氢气的速率较快可能与铜单质有关,他质疑的理由是锌会与硫酸铜反应生成铜.
【继续探究】请你设计一个实验方案验证丁同学的观点是否正确.
| 编号 | 实验步骤 | 实验现象比较 | 实验结论 |
| ① | 取1g锌粒于锥形瓶中,加入20ml20%的稀硫酸 | ②中反应速率比①快 | 产生氢气的速率较快与铜单质有关 |
| ② | 取1g锌粒于锥形瓶,加入少量铜,再加入20mL20%的稀硫酸 |
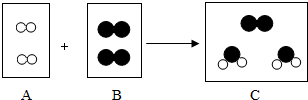 在宏观、微观和符号之间建立联系,是化不学科的特点.如图是某化学反应的微观过程示意图(“
在宏观、微观和符号之间建立联系,是化不学科的特点.如图是某化学反应的微观过程示意图(“ ”表示氧原子,“
”表示氧原子,“ ”表示氢原子).
”表示氢原子).