题目内容
15.下列实验操作中,正确的是( )| A. |  滴加液体 | B. |  加热液体 | ||
| C. |  稀释浓硫酸 | D. |  测定空气中氧气的含量 |
分析 A、根据胶头滴管的使用方法进行分析.
B、根据给试管中的液体加热的方法进行分析判断.
C、根据稀释浓硫酸的方法进行分析判断.
D、根据测定空气中氧气的含量的方法进行分析判断.
解答 解:A、使用胶头滴管滴加少量液体时,注意胶头滴管的不能伸入到试管内或接触试管内壁.应垂直悬空在试管口上方滴加液体,防止污染胶头滴管,图中所示操作错误.
B、给试管中的液体加热时,用酒精灯的外焰加热试管里的液体,且液体体积不能超过试管容积的$\frac{1}{3}$,试管口要向上倾斜45度,图中所示操作错误.
C、稀释浓硫酸时,要把浓硫酸缓缓地沿器壁注入水中,同时用玻璃棒不断搅拌,以使热量及时地扩散;一定不能把水注入浓硫酸中;图中所示操作正确.
D、木炭虽然能在空气中燃烧,但不能用来测定空气中氧气的含量,因其产物也是气体,可用红磷来测定空气中氧气的含量,图中所示操作错误.
故选BC.
点评 本题难度不大,熟悉各种仪器的用途及使用注意事项、掌握常见化学实验基本操作的注意事项是解答此类试题的关键.

练习册系列答案
相关题目
5.几年前,广西河池宜州市境内龙江河发生了镉浓度超标事件.根据该事件某化学活动小组开展了一次关于金属镉与铜、银活动顺序的探究及镉污染事故处理方法的研讨活动.
查阅资料:①镉(Cd)是一种银白色金属,在化合物中通常表现为+2价;
②水体中镉元素通常以氯化镉的形式存在;
③氯化镉能溶于水,氢氧化镉难溶于水.
(一)金属镉与铜、银活动性顺序的探究
实验结论:活动性顺序:镉>铜>银
(二)对镉污染事故处理方法的讨论
小聪认为可用向受污染河段抛撒过量烧碱固体的方法除去氯化镉,反应原理用化学方程式表示为CdCl2+2NaOH═Cd(OH)2↓+2NaCl.小敏认为该方案虽然有效,但有缺陷,原因是烧碱具有强腐蚀性.受小聪与小敏启发,你认为可以用熟石灰(写俗称)代替烧碱.
查阅资料:①镉(Cd)是一种银白色金属,在化合物中通常表现为+2价;
②水体中镉元素通常以氯化镉的形式存在;
③氯化镉能溶于水,氢氧化镉难溶于水.
(一)金属镉与铜、银活动性顺序的探究
| 实验步骤 | 实验现象 | 实验结论 |
| 分别取适量镉、铜、银于试管中,加入足量稀盐酸 | 镉表面有气泡产生,铜、银表面无气泡产生 | 镉的活动性顺序大于铜与银 |
| 取适量铜于试管中,加入少量硝酸银溶液 | 铜表面析出了一层银白色物质, 溶液由无色变为蓝色. | 铜的活动性顺序大于银 |
(二)对镉污染事故处理方法的讨论
小聪认为可用向受污染河段抛撒过量烧碱固体的方法除去氯化镉,反应原理用化学方程式表示为CdCl2+2NaOH═Cd(OH)2↓+2NaCl.小敏认为该方案虽然有效,但有缺陷,原因是烧碱具有强腐蚀性.受小聪与小敏启发,你认为可以用熟石灰(写俗称)代替烧碱.
6.某兴趣小组同学为了寻找纯度超过85%的石灰石,对一样品进行了如下定量实验:
试通过分析计算:
(1)该实验中生成的二氧化碳的质量是4.4g.
(2)该石灰石样品的纯度是否符合要求?(该石灰石样品中杂质不与盐酸反应也不溶于水)
| 实验步骤 | ①称取烧杯的质量 | ②将适量盐酸加入烧杯中并称重 | ③称取少量石灰石样品加入烧杯中,使之与过量稀盐酸反应 | ④待反应完全后,称重 |
| 实验图示 | 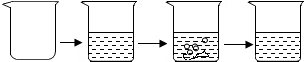 | |||
| 实验数据 | 烧杯的质量为50.0g | 烧杯和盐酸的质量为100.0g | 石灰石样品的质量为12.0g | 烧杯和其中剩余混合物的质量为107.6g |
(1)该实验中生成的二氧化碳的质量是4.4g.
(2)该石灰石样品的纯度是否符合要求?(该石灰石样品中杂质不与盐酸反应也不溶于水)
3.下列实验操作正确的是( )
| A. |  | B. |  | C. |  | D. |  |
10. 实验室中有一瓶标签受损的无色液体,如图所示,这瓶无色液体是什么呢?实验老师告诉大家,该液体只能是过氧化氢溶液、稀硫酸和蒸馏水中的一种.
实验室中有一瓶标签受损的无色液体,如图所示,这瓶无色液体是什么呢?实验老师告诉大家,该液体只能是过氧化氢溶液、稀硫酸和蒸馏水中的一种.
(1)大家讨论后一致认为不可能是蒸馏水,理由是由标签知该液体是混合物,而蒸馏水为纯净物.
(2)为确定该液体成分,同学们继续进行了如下实验探究:
【反思交流】
(3)大家认为标签受损的原因可能是倾倒液体时标签没有向着手心;
(4)如果该液体是过氧化氢溶液,则步骤一中发生反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
 实验室中有一瓶标签受损的无色液体,如图所示,这瓶无色液体是什么呢?实验老师告诉大家,该液体只能是过氧化氢溶液、稀硫酸和蒸馏水中的一种.
实验室中有一瓶标签受损的无色液体,如图所示,这瓶无色液体是什么呢?实验老师告诉大家,该液体只能是过氧化氢溶液、稀硫酸和蒸馏水中的一种.(1)大家讨论后一致认为不可能是蒸馏水,理由是由标签知该液体是混合物,而蒸馏水为纯净物.
(2)为确定该液体成分,同学们继续进行了如下实验探究:
| 实验操作 | 实验现象 | 实验结论 |
| 步骤一:取该液体适量与试管中,向其中加入少量二氧化锰粉末 | 没有气泡产生 | 该液体不是过氧化氢溶液 |
| 步骤二:取该液体适量于试管中,向其中滴加少量氯化钡溶液 | 产生白色沉淀 | 该液体是稀硫酸 |
(3)大家认为标签受损的原因可能是倾倒液体时标签没有向着手心;
(4)如果该液体是过氧化氢溶液,则步骤一中发生反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑.
20.下列有关物构成的说法不正确的是( )
| A. | Hg由原子构成,H2由分子构成 | |
| B. |  和 和 最外层都有2个电子,化学性质相似 最外层都有2个电子,化学性质相似 | |
| C. | X原子的核内质子数为n,该原子核外电子数也为n | |
| D. |  、 、 ,分别表示Mg2+和Cl- ,分别表示Mg2+和Cl- |
11.学习小组对“氯碱工业”生产的烧碱样品(可能含Na2CO3、NaCl等杂质)进行探究.
Ⅰ.定性探究
Ⅱ.定量探究:用下列装置测量烧碱样品中含碳酸钠的质量分数(提示:碱石灰成分为CaO和NaOH).请回答:
(1)装置A中氢氧化钠溶液的作用是什么?
(2)实验前先通一会儿空气后再进行装置B的化学反应,其原因是什么?
(3)写出装置B中反应产生气泡的化学方程式.
(4)本实验通过碱石灰增重测定CO2的质量,E装置的作用是什么?
Ⅲ.延伸计算:氢氧化钾在空气中久置容易变质.取已变质的氢氧化钾溶液100g,向其中加入溶质质量分数为9.8%的稀硫酸100g,恰好完全反应得到中性溶液.试计算蒸干该溶液可得到的固体的质量.

Ⅰ.定性探究
| 实验步骤 | 实验现象 | 解释或结论 |
| 取适量烧碱样品置于试管中,加水溶解,向所得的溶液中逐滴加入过量的稀硝酸. | 开始时无明显现象,一段时间后产生能使澄清石灰水变浑浊的气体 | 样品中含有的杂质是碳酸钠. |
| 向上述所得的溶液中滴加几滴AgNO3溶液 | 产生白色沉淀 | 样品中还含有的杂质是氯化钠. |
(1)装置A中氢氧化钠溶液的作用是什么?
(2)实验前先通一会儿空气后再进行装置B的化学反应,其原因是什么?
(3)写出装置B中反应产生气泡的化学方程式.
(4)本实验通过碱石灰增重测定CO2的质量,E装置的作用是什么?
Ⅲ.延伸计算:氢氧化钾在空气中久置容易变质.取已变质的氢氧化钾溶液100g,向其中加入溶质质量分数为9.8%的稀硫酸100g,恰好完全反应得到中性溶液.试计算蒸干该溶液可得到的固体的质量.

 人类的日常生活和工农业生产离不开水,请回答:
人类的日常生活和工农业生产离不开水,请回答:
