题目内容
14.为研究NaOH与盐酸的反应,同学们用以下试剂设计不同方案进行探究.实验试剂:镁条、蒸馏水、稀盐酸、NaOH溶液、NaCl溶液等
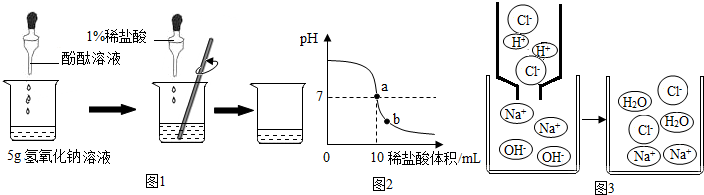
(1)小明取少量NaOH溶液于试管中,滴入酚酞,溶液变红,再滴加稀盐酸,振荡,红色褪去,可推断NaOH与盐酸发生了反应.反应的化学方程式为NaOH+HCl═NaCl+H2O.
(2)小刚取体积相同的稀盐酸分别于甲、乙两支试管中,向甲中先加1mL水,充分混合后再放入镁条,向乙中先加入1mL NaOH溶液,充分混合后再放入镁条.观察到甲中有气泡冒出,乙中无气泡(或气泡少),可推断NaOH与盐酸发生了反应.
(3)小华利用溶液导电性进行实验.分别测定几种试剂的导电性,获得相关数据:
| 实验序号 | A | B | C | D |
| 试剂 | 蒸馏水 | 稀盐酸 | NaOH溶液 | NaCl溶液 |
| 电流强度/mA | 约为0 | 0.09 | 0.09 | 0.09 |
Ⅰ.溶液中若存在自由移动的离子,通电时就会发生定向移动,从而形成了电流.
Ⅱ.相同电压下,等体积溶液中,所含离子数目越多,电流就越大.
①对比实验A、C的数据,可推知NaOH溶液中除水分子外还含有自由移动的Na+和OH-(填化学符号).
②实验B、D中电流强度相等,说明等体积的稀盐酸和NaCl溶液中所含Cl-的数目相等(填写“相等”或“不相等”).
③各取10mL NaOH溶液于两个小烧杯中,分别加入10mL NaCl溶液和10mL稀盐酸(所得混合溶液体积均约为20mL),测两种混合溶液的导电性,电流示数依次为I1和I2.根据I1> I2(填“>”、“<”或“=”),也可推断氢氧化钠和盐酸发生了反应.
分析 (1)根据中和反应的实质和规律书写化学方程式;
(2)根据镁的化学性质进行分析;
(3)①NaOH溶液中除水分子外还含有自由移动的钠离子和氢氧根离子;
②电流强度与离子浓度成正比来分析;
③氢氧化钠与盐酸反应生成水,使溶液中离子减少来分析;
解答 解:(1)氢氧化钠与盐酸反应生成氯化钠和水;
(2)甲中加1mL水,盐酸没消耗,故加入镁条有气泡产生;乙中加入1mL NaOH溶液后与盐酸反应,故加入镁条无气泡产生或产生气泡较少;
(3)①NaOH溶液中除水分子外还含有自由移动的钠离子和氢氧根离子;
②电流强度与离子浓度有关,实验B、D中电流强度相等,说明等体积的稀盐酸和NaCl溶液中所含Cl-的数目相等;
③氢氧化钠氢氧根离子与盐酸中的氢离子反应生成水,使溶液中离子减少;而 NaOH溶液与氯化钠溶液不反应离子不减少,故I1大于I2.
答案:(1)NaOH+HCl═NaCl+H2O;
(2)甲中有气泡冒出.乙中无气泡(或气泡少);
(3)①Na+和OH-;②相等;③>.
点评 结合课本知识和实验技能,考查了学生的分析问题、解决问题的能力;此题综合性较强,考查出学生将理论知识与实验相结合的能力,还考查学生的创新能力,是一道不错的综合题.

练习册系列答案
 期末好成绩系列答案
期末好成绩系列答案 99加1领先期末特训卷系列答案
99加1领先期末特训卷系列答案 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案
相关题目
3.X、Y、Z 三种常见金属及其盐溶液存在以下反应,则三种金属的活动性顺序正确的是( )
①X+H2SO4=XSO4+H2↑②Y+H2SO4不发生反应③Y+ZSO4=YSO4+Z.
①X+H2SO4=XSO4+H2↑②Y+H2SO4不发生反应③Y+ZSO4=YSO4+Z.
| A. | Y>X>Z | B. | X>Z>Y | C. | X>Y>Z | D. | Z>X>Y |
15.化学与生活密切相关,下列做法合理的是( )
| A. | 油锅着火用水浇灭 | B. | 电器着火用泡沫灭火器灭火 | ||
| C. | 用明火检查液化气罐是否漏气 | D. | 火场逃生时用湿毛巾捂住口鼻 |