题目内容
13.把一定质量的四种物质放入一密闭容器中,在一定条件下反应一段时间后,测得反应后各物质的质量如下,下列说法中正确的是( )| 物质 | CO2 | O2 | H2O | W |
| 反应前的质量(g) | 2 | 98 | 5 | 51 |
| 反应后的质量(g) | X | 2 | 59 | 5 |
| A. | 该反应是化合反应 | |
| B. | X的值是88 | |
| C. | W是一种由碳、氢、氧三种元素组成的化合物 | |
| D. | W是一种只由碳、氢两种元素组成的化合物 |
分析 根据表格中的数据和质量守恒定律,则2+98+5+51=X+2+59+5,则解得X=90,考虑质量增加的为生成物、质量减少的为反应物,则可判断反应物与生成物,进而书写出反应的表达式,判断反应的类型据此回答问题即可.
解答 解:根据表格中的数据和质量守恒定律,则2+98+5+51=X+2+59+5,则解得X=90,考虑质量增加的为生成物、质量减少的为反应物,则可判断反应物为W、氧气,生成物为水和二氧化碳;此反应的表达式可表示为W+O2→CO2+H2O.
A、由于该反应的表达式是W+O2→CO2+H2O,生成物是两种,不符合“多变一”的化合反应特征;
B、根据表格中的数据和质量守恒定律,则2+98+5+51=X+2+59+5,则解得X=90;
C、有反应表达式可以看出W中一定含有碳氢两种元素,是否含有氧元素则要通过生成物中的氧元素与反应的氧气质量进行比较,生成的水中氧元素=(59-5)g×($\frac{16}{18}$×100%)=48g,二氧化碳中氧元素的质量=(90-2)g×($\frac{16×2}{44}×100%$)=64g,两者的质量和为48+64=112g,而参加反应的氧气的质量=98g-2g=96g,所以可判断W中含有氧元素;
D、由C的分析可知W是一种由碳、氢、氧三种元素组成的化合物;
故选C.
点评 化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和,这是书写化学方程式和进行相关方面计算的基础.

练习册系列答案
相关题目
17.下列变化中,属于化学变化的是( )
| A. | 干冰升华 | B. | 纸张燃烧 | C. | 铜丝折弯 | D. | 酒精挥发 |
1.物质甲和乙完全燃烧生成物质丙和丁,各物质的微观示意图如表所示.
下列说法错误的是( )
| 物质 | 甲 | 乙 | 丙 | 丁 |  |
| 分子示意图 |  |  |  |  |
| A. | 甲物质属于有机物 | |
| B. | 该反应属于置换反应 | |
| C. | 反应后元素的种类不变 | |
| D. | 该反应的化学方程式为:C2H4+302 $\frac{\underline{\;点燃\;}}{\;}$2C02+2H20 |
18. 在今天的化学兴趣小组活动中,指导老师拿来了一包已经失效的石灰干燥剂.为了确定该干燥剂的组成,同学们进行了如下的探究活动:
在今天的化学兴趣小组活动中,指导老师拿来了一包已经失效的石灰干燥剂.为了确定该干燥剂的组成,同学们进行了如下的探究活动:
小萌同学通过探究发现,此包装袋中的生石灰干燥剂已经完全变质失效.他采用的探究方法是:取少量样品于试管中,加入少量水,用手触摸试管外壁,没有明显的放热现象.此实验中加入的水必须是少量的,理由是如果所加的水较多,则水会吸收反应产生的热量,影响实验的结论.
【查阅资料】
石灰干燥剂的成分为CaO,请写出该干燥剂干燥原理CaO+H2O=Ca(OH)2(用化学方程式表示).
【提出猜想】①该干燥剂的成分为Ca(OH)2
②该干燥剂的成分为CaCO3
③你的猜想是CaCO3、Ca(OH)2;
【方案设计】小组成员设计了如下的实验方案:
方案一:取样滴加稀盐酸,有气泡产生,则白色固体只存在CaCO3;
方案二:取样滴加少量稀盐酸,没有气泡产生,则白色固体中只存在Ca(OH)2;
方案三:取样加入水中,振荡,静置,上层为清液,下层出现固体不溶物,取上层清液滴加酚酞试液,变红,则固体为CaCO3和Ca(OH)2的混合物.
【实验分析】小组成员经过讨论发现上述实验方案都存在着问题.
(1)上述方案一中存在的问题是不能说明白色固体中是否含有Ca(OH)2.
(2)上述方案二的结论是错误的,原因是由于加入的盐酸是少量的,可能只是与氢氧化钙发生了反应,还没有与碳酸钙反应,无法证明没有碳酸钙的存在.
(3)实验方案三中的结论也有些不妥,是因为不能说明白色固体中含有CaCO3,因为不溶物可能是微溶于水的氢氧化钙.
(4)实验证实,该固体是CaCO3和Ca(OH)2的混合物,请你再设计一种实验方案予以证明,只要写出实验步骤和现象即可.
【数据分析】
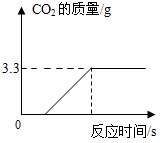
为了进一步确定该混合物中CaCO3的质量分数,实验小组的同学取了15克样品,加入足量的稀盐酸,实验测得生成CO2气体的质量如图所示,请据图计算该混合物中CaCO3的质量分数.
【反思与评价】
实验中造成计算结果与实际值相比偏小,则可能的原因是有部分生成的二氧化碳气体因溶解于水而没有全部逸出.
 在今天的化学兴趣小组活动中,指导老师拿来了一包已经失效的石灰干燥剂.为了确定该干燥剂的组成,同学们进行了如下的探究活动:
在今天的化学兴趣小组活动中,指导老师拿来了一包已经失效的石灰干燥剂.为了确定该干燥剂的组成,同学们进行了如下的探究活动:小萌同学通过探究发现,此包装袋中的生石灰干燥剂已经完全变质失效.他采用的探究方法是:取少量样品于试管中,加入少量水,用手触摸试管外壁,没有明显的放热现象.此实验中加入的水必须是少量的,理由是如果所加的水较多,则水会吸收反应产生的热量,影响实验的结论.
【查阅资料】
石灰干燥剂的成分为CaO,请写出该干燥剂干燥原理CaO+H2O=Ca(OH)2(用化学方程式表示).
【提出猜想】①该干燥剂的成分为Ca(OH)2
②该干燥剂的成分为CaCO3
③你的猜想是CaCO3、Ca(OH)2;
【方案设计】小组成员设计了如下的实验方案:
方案一:取样滴加稀盐酸,有气泡产生,则白色固体只存在CaCO3;
方案二:取样滴加少量稀盐酸,没有气泡产生,则白色固体中只存在Ca(OH)2;
方案三:取样加入水中,振荡,静置,上层为清液,下层出现固体不溶物,取上层清液滴加酚酞试液,变红,则固体为CaCO3和Ca(OH)2的混合物.
【实验分析】小组成员经过讨论发现上述实验方案都存在着问题.
(1)上述方案一中存在的问题是不能说明白色固体中是否含有Ca(OH)2.
(2)上述方案二的结论是错误的,原因是由于加入的盐酸是少量的,可能只是与氢氧化钙发生了反应,还没有与碳酸钙反应,无法证明没有碳酸钙的存在.
(3)实验方案三中的结论也有些不妥,是因为不能说明白色固体中含有CaCO3,因为不溶物可能是微溶于水的氢氧化钙.
(4)实验证实,该固体是CaCO3和Ca(OH)2的混合物,请你再设计一种实验方案予以证明,只要写出实验步骤和现象即可.
| 实验操作步骤 | 实验现象 |
| (1)取样,滴加足量稀盐酸 (2)另取适量的样品,加足量的水溶解,静置取上层清液,滴加酚酞试液 | (1)产生大量的气泡 (2)溶液呈红色 |
为了进一步确定该混合物中CaCO3的质量分数,实验小组的同学取了15克样品,加入足量的稀盐酸,实验测得生成CO2气体的质量如图所示,请据图计算该混合物中CaCO3的质量分数.
【反思与评价】
实验中造成计算结果与实际值相比偏小,则可能的原因是有部分生成的二氧化碳气体因溶解于水而没有全部逸出.
2.Sb2O5是一种重要的阻燃剂,工业制取该物质的化学方程式为:Sb2O3+2X═Sb2O5+2H2O,则X的化学式为( )
| A. | H2 | B. | O2 | C. | H2O2 | D. | H2SbO4 |
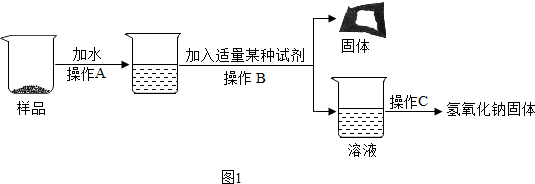
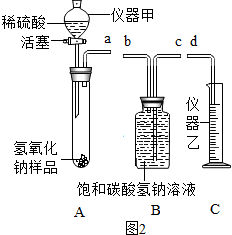
 图中A、B、C、D是初中化学常见的四种不同类别的无机化合物.A、B、C含有相同的金属元素.图中“━”表示相连物质能发生化学反应,“→”表示两种物质间的转化关系.(部分反应物、生成物及反应条件省略)
图中A、B、C、D是初中化学常见的四种不同类别的无机化合物.A、B、C含有相同的金属元素.图中“━”表示相连物质能发生化学反应,“→”表示两种物质间的转化关系.(部分反应物、生成物及反应条件省略) .
.
