题目内容
6.化工生产中需要对原料提纯,以利于提高产品质量.经测定某氯化钠样品中混有硫酸钠,为了除杂质并制得纯净的氯化钠固体,在实验室研究中某学生设计方案如下.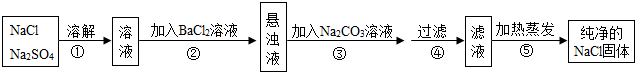
回答下列问题.
(1)操作①溶解过程中用玻璃棒搅拌的目的是加速溶解;步骤④过滤用玻璃棒的目的是引流.
(2)操作②发生的化学反应的化学方程式为Na2SO4+BaCl2═BaSO4↓+2NaCl,能否用硝酸钡溶液?说明理由硝酸钡溶液和硫酸钠反应生成硫酸钡沉淀和硝酸钠,硝酸钠属于新的杂质;
(3)实际提纯操作过程中,每步所加药品都稍过量,目的是除尽杂质;
(4)步骤⑤加热蒸发时,应蒸发至B(填序号);
A.完全蒸干时停止加热
B.快干时停止加热,利用余热蒸干
C.有大量固体析出时停止加热,过滤弃去剩余的少量溶液
(5)此设计方案是否严密,说明理由不严密,所得氯化钠固体中可能混有少量碳酸钠.
分析 (1)根据溶解过程中用玻璃棒搅拌的目的是加速溶解;玻璃棒在过滤时起引流作用,进行分析;
(2)根据操作②氯化钡溶液与硫酸钠溶液反应生成硫酸钡沉淀和氯化钠,进行解答;
根据硝酸钡溶液和硫酸钠反应生成硫酸钡沉淀和硝酸钠,硝酸钠属于新的杂质,进行解答;
(3)根据药品需要过量,充分除去多余的离子,进行解答;
(4)考虑停止加热蒸发的时机;
(5)考虑碳酸钠溶液过量,没有除去.
解答 解:(1)过滤操作中玻璃棒的作用是引流,蒸发结晶操作中待蒸发皿中出现较多固体停止加热;
(2)操作②氯化钡溶液与硫酸钠溶液反应会生成硫酸钡沉淀和氯化钠,故其化学方程式为:Na2SO4+BaCl2═BaSO4↓+2NaCl;而硝酸钡溶液和硫酸钠反应生成硫酸钡沉淀和硝酸钠,硝酸钠属于新的杂质,所以不能用硝酸钡溶液;
(3)实际提纯操作过程中,每步所加药品都稍过量,目的是加入过量氯化钡溶液,充分除去硫酸钠;加入过量碳酸钠溶液,充分除去氯化钡,即除尽杂质;
(4)步骤⑤加热蒸发时,应蒸发至快干时停止加热,利用余热蒸干;
(5)最后过量的碳酸钠没有除去,所得氯化钠固体中可能混有少量碳酸钠,所以此设计方案不严密.
故答案为:
(1)加速溶解; 引流.
(2)Na2SO4+BaCl2═BaSO4↓+2NaCl,硝酸钡溶液和硫酸钠反应生成硫酸钡沉淀和硝酸钠,硝酸钠属于新的杂质;
(3)除尽杂质;(4)B;
(5)不严密,所得氯化钠固体中可能混有少量碳酸钠.
点评 本题主要考查了物质的分离操作和除去杂质的方法,要根据物质的性质选择适当的方法或试剂进行解答,本题难度较大,培养学生对知识的应用和理解的能力.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
16.如表除杂方法中,所用试剂和操作均正确的是( )
| 选项 | 物质(括号内为杂质) | 杂质 | 除杂的试剂和方法 |
| A | NaOH溶液(Na2SO4) | 过量的Ba(OH)2溶液 | 过滤 |
| B | KCl(MnO2) | 水 | 溶解、过滤、洗涤干燥 |
| C | CO(CO2) | 足量氢氧化钠溶液 | 通入并干燥 |
| D | NaCl溶液(Na2CO3) | 足量稀盐酸 | 蒸发 |
| A. | A | B. | B | C. | C | D. | D |
17.将10%的氯化钠溶液稀释至5%时,所使用的仪器中通常不包括( )
| A. | 酒精灯 | B. | 量筒 | C. | 烧杯 | D. | 玻璃棒 |
14.实验是学习化学的重要途径.如图化学实验基本操作不正确的是( )
| A. |  熄灭酒精灯 | B. |  读出液体的体积 | C. |  加热液体 | D. |  稀释浓硫酸 |
18.下列化学用语中对“2”的理解错误的是( )
| A. | Fe2+中的“2”表示一个亚铁离子带两个単位正电荷 | |
| B. | 2C0中的“2”表示两个一氧化碳分子 | |
| C. | Mg$\frac{-2}{C{O}_{3}}$中的“2”表示碳酸根的化合价为-2价 | |
| D. | 2N中的“2”表示两个氮元素 |
16.下列常见物质中,属于纯净物的是( )
| A. | 清新的空气 | B. | 生铁 | C. | 石油 | D. | 蒸馏水 |

 某方便面的营养成分表如图(其中碳水化合物主要指淀粉等):
某方便面的营养成分表如图(其中碳水化合物主要指淀粉等):