题目内容
18.下列4个坐标图分别表示4个实验过程中某些量的变化,其中正确的是( )| A. |  向盐酸中加入水 向盐酸中加入水 | B. |  10mL5%的H2O2 溶液分解 | ||
| C. |  将饱和石灰水升温 将饱和石灰水升温 | D. |  向一定量的稀盐酸中加入铁粉 向一定量的稀盐酸中加入铁粉 |
分析 A.根据溶液的酸碱性与pH的关系来分析;
B.根据催化剂的性质来分析;
C.根据温度对氢氧化钙溶解度的影响来分析;
D.根据金属与酸的反应来分析.
解答 解:A.盐酸显酸性,无论加多少水稀释,仍为酸性,pH始终<7,故错误;
B.过氧化氢溶液的浓度相同,加入催化剂能加快其反应的速率,但是最终生成氧气的质量是相通的,故正确;
C.氢氧化钙的溶解度随着温度的升高而减小,所以将饱和石灰水升温会析出少量的氢氧化钙,溶液的质量会减小,故错误;
D.向一定量的稀盐酸中加入铁粉,铁与盐酸反应生成氯化亚铁和氢气,随着铁粉的加入,溶液中铁元素的质量增加,当盐酸完全参与反应后,再加铁粉,溶液中铁元素的质量也不再改变,故错误.
故选B.
点评 此题是多个知识点的考查题,能对多个物质的反应过程进行有效分析,并能结合读懂图象是解题的关键.

练习册系列答案
相关题目
3.小明将一定量铜粉和锌粉的混合物放入一定量的硝酸银溶液中,使其充分反应后过滤,得到滤渣和滤液.下列对滤渣组成的分析,不可能出现的一组是( )
| A. | Ag | B. | Ag 和 Zn | C. | Cu 和 Ag | D. | Cu、Zn 和 Ag |
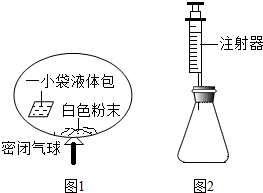
7.某研究小组对自动充气气球(示意图如图1)进行下列探究.
[查阅资料]该气球充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气.
(1)为检验气体是二氧化碳,可选用氢氧化钙溶液(填试剂名称)、
探究一:液体包内溶液酸碱性的探究
(2)室温时,用pH试纸测得溶液的pH=3,则该溶液呈酸性.
探究二:白色粉末成分的探究
[猜想与假设]甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠.
[设计并进行实验]
(3)将少量白色粉末放入水中搅拌,固体全部溶解,说明甲同学的猜想不正确(填“正确”或“不正确”)、
(4)室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%盐酸(装置如图2),记录如表:
实验①的化学方程式为NaHCO3+HCl=NaCl+H2O+CO2↑;表中x=0.1;V1 >V2(填“>”、“<”或“=”)、
[分析并得出结论]
(5)白色粉末是碳酸氢钠、
[查阅资料]该气球充气原理是:通过挤破液体包,使液体与白色粉末接触产生二氧化碳气体,实现气球自动充气.
(1)为检验气体是二氧化碳,可选用氢氧化钙溶液(填试剂名称)、
探究一:液体包内溶液酸碱性的探究
(2)室温时,用pH试纸测得溶液的pH=3,则该溶液呈酸性.
探究二:白色粉末成分的探究
[猜想与假设]甲同学认为是碳酸钙;乙同学认为是碳酸钠;丙同学认为是碳酸氢钠.
[设计并进行实验]
(3)将少量白色粉末放入水中搅拌,固体全部溶解,说明甲同学的猜想不正确(填“正确”或“不正确”)、
(4)室温时,分别向盛有碳酸氢钠、碳酸钠和白色粉末样品的锥形瓶中注入等体积、足量的10%盐酸(装置如图2),记录如表:

| 实验编号 | 锥形瓶内物质 | 最终得到CO2体积/mL | |
| 名称 | 质量/g | ||
| ① | 碳酸氢钠 | 0、10 | V1 |
| ② | 碳酸钠 | 0、10 | V2 |
| ③ | 白色粉末 | x | V1 |
[分析并得出结论]
(5)白色粉末是碳酸氢钠、
 如图所示装置中的现象是实验过程中呈现的实验现象,请回答相关问题.
如图所示装置中的现象是实验过程中呈现的实验现象,请回答相关问题. 化学就在我们身边,与我们的生活有着密切的联系.
化学就在我们身边,与我们的生活有着密切的联系.