题目内容
11.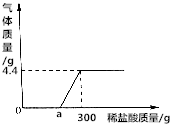 取24.8gCaCO3和Ca(OH)2固体混合物于烧杯中,向烧杯中不断加入质量分数为7.3%的稀盐酸.反应过程中测得生成气体的质量与所加稀盐酸质量的关系如图所示.
取24.8gCaCO3和Ca(OH)2固体混合物于烧杯中,向烧杯中不断加入质量分数为7.3%的稀盐酸.反应过程中测得生成气体的质量与所加稀盐酸质量的关系如图所示.(1)固体混合物中Ca(OH)2的质量是多少?
(2)a点的值为多少?
(3)若恰好完全反应时,得到不饱和溶液,向此溶液中加入12.6g水,所得溶液中溶质质量分数为多少?
分析 根据碳酸钙与盐酸反应的化学方程式,由二氧化碳的质量可以计算出消耗的碳酸钙质量、消耗的稀盐酸的溶质质量,进一步求解固体混合物中Ca(OH)2的质量,反应时所用盐酸的质量(可得a点的值),根据氯化氢与氯化钙的质量关系可得氯化钙的质量,进一步求所得溶液中溶质质量分数.
解答 解:(1)由图象可知生成二氧化碳的质量为4.4g;
设消耗氯化氢的质量为x,消耗的碳酸钙质量为y
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 73 44
y x 4.4g
$\frac{100}{y}=\frac{73}{x}=\frac{44}{4.4g}$
y=10g,x=7.3g
固体混合物中Ca(OH)2的质量是24.8g-10g=14.8g.
(2)与碳酸钙反应消耗的盐酸质量为$\frac{7.3g}{7.3%}$=100g.
所以与氢氧化钙反应的盐酸质量为300g-100g=200g;a点的值为200;
(3)根据CaCO3和Ca(OH)2与HCl反应的方程式可知,HCl与CaCl2的关系为:2HCl~CaCl2
设反应生成氯化钙的质量为z.
2HCl~CaCl2
73 111
300g×7.3% z
$\frac{73}{300g×7.3%}=\frac{111}{z}$
z=33.3g
所得溶液中溶质质量分数为$\frac{33.3g}{24.8g+300g-4.4g+12.6g}$×100%=10%
答:(1)固体混合物中Ca(OH)2的质量是14.8g.
(2)a点的值为200.
(3)所得溶液中溶质质量分数为10%.
点评 本题是借助于数学模型,利用图象的方式来分析和解决化学计算中的有关问题,要求学生有较强的识图能力和数据分析能力.

 名校通行证有效作业系列答案
名校通行证有效作业系列答案①下表是KNO3、NaCl在不同温度下的溶解度(单位:g/100g水).
| 温度(℃) | 0 | 20 | 40 | 60 | 80 | 100 |
| KNO3 | 13.3 | 31.6 | 63.9 | 110 | 169 | 246 |
| NaCl | 35.7 | 36.0 | 36.6 | 37.3 | 38.4 | 39.8 |
Ⅱ.从NaCl溶液中得到NaCl晶体的方法是蒸发结晶.
②用硫酸铜进行如图所示的实验,完成下列填空(用编号表示).

Ⅲ.所得三种溶液中:一定属于饱和溶液的是A,溶液中溶质质量分数的大小关系是C>B>A.
| A. | 氯化钠溶液和硝酸银溶液 | B. | 氢氧化镁与稀盐酸 | ||
| C. | 碳酸钠溶液与硝酸钾溶液 | D. | 铁和硫酸铜溶液 |
| A. | 用甲醛溶液浸泡海产品保鲜 | |
| B. | 食用“加碘食盐”,可预防甲状腺肿大 | |
| C. | 用地沟油精制食用油,可节约成本 | |
| D. | 食品中添加大量防腐剂以延长其保质期 |
 弄清事物的原因才能找到解决办法,掌握燃烧的条件就能学会灭火的方法.结合图示将下列灭火事例进行分类.
弄清事物的原因才能找到解决办法,掌握燃烧的条件就能学会灭火的方法.结合图示将下列灭火事例进行分类.a.釜底抽薪 b.吹灭蜡烛 c.用沙土灭火
d.用高压水枪对楼房灭火 e.关闭炉灶阀门熄火
| 主要灭火原理 | 相应的事例(填字母) |
| A.隔绝氧气 | c |
| B.清除可燃物 | ae |
| C.降低可燃物的温度至着火点以下 | bd |
| A. | 金刚石与石墨物理性质差异较大,是由于碳原子的结构不同 | |
| B. | 盐酸与硫酸化学性质相似,是由于在水溶液中都解离出H+ | |
| C. | 在化学反应中有新物质生成,是由于反应中分子和原子的种类都发生了变化 | |
| D. | “干冰升华”是由于分子本身的体积急剧增大 |
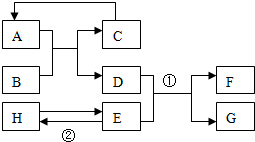 已知A-H均为初中化学常见的物质,其中A、C是组成元素相同的气体,且C能产生温室效应:是赤铁矿的主要成分;F是紫红色金属;H是蓝色沉淀.根据如图所示的转化关系(图中反应条件均已略去),请回答:
已知A-H均为初中化学常见的物质,其中A、C是组成元素相同的气体,且C能产生温室效应:是赤铁矿的主要成分;F是紫红色金属;H是蓝色沉淀.根据如图所示的转化关系(图中反应条件均已略去),请回答: 实验室制取二氧化碳后,对回收的盐酸和氧化钙混合溶液(不考虑其他杂质)进行了以下实验:取100g该溶液于烧杯中,滴入40g溶质质量分数为21.2%的碳酸钠溶液,充分反应后过滤,滴入碳酸钠溶液质量与生成沉淀质量的关系如图所示.求:
实验室制取二氧化碳后,对回收的盐酸和氧化钙混合溶液(不考虑其他杂质)进行了以下实验:取100g该溶液于烧杯中,滴入40g溶质质量分数为21.2%的碳酸钠溶液,充分反应后过滤,滴入碳酸钠溶液质量与生成沉淀质量的关系如图所示.求: