题目内容
3. 砝码是化学实验室中的常用实验器材,如图所示是一盒砝码的实物图.请你回答下列问题:
砝码是化学实验室中的常用实验器材,如图所示是一盒砝码的实物图.请你回答下列问题:(1)不锈钢属于混合物(填“单质”、“化合物”或“混合物”);图中属于合成材料的是塑料.
(2)砝码表面镀铬不仅美观,还可以防止砝码生锈.
(3)铬能缓慢溶解于稀盐酸和稀硫酸,由此推测铬的金属活动性比铜强.铬在浓硫酸中发生反应的化学方程式为:2Cr+6H2SO4(浓)═Cr2(SO4)3+3SO2↑+6H2O,产生的SO2可用碱性(填“酸”或“碱”)溶液来吸收,以减少对环境的污染.
分析 (1)根据合金属于混合物解答;根据有机合成材料是指人工利用有机高分子化合物制成的材料,主要包括塑料、合成纤维、合成橡胶等,据此分析解答即可;
(2)根据防止生锈的条件解答;
(3)根据在金属活动性顺序中,氢前的金属能与酸反应生成氢气,由质量守恒定律:反应前后,原子种类、数目均不变,据此由反应的化学方程式推断生成物X的化学式.
解答 解:(1)不锈钢是合金,属于混合物;图中属于合成材料的是塑料;
(2)砝码表面镀铬不仅美观,还可以防止砝码生锈;
(3)在金属活动性顺序中,氢前的金属能与酸反应生成氢气,铬能缓慢溶解于稀盐酸和稀硫酸,由此推测铬的金属活动性比较强;
由质量守恒定律:反应前后,原子种类、数目均不变,由反应的化学方程式2Cr+6H2SO4(浓)═_______+3SO2↑+6H2O,
反应前铬、氢、硫、氧原子个数分别为2、12、6、24,反应后的生成物中铬、氢、硫、氧原子个数分别为0、12、3、12,根据反应前后原子种类、数目不变,则每个分子由2个铬原子、3个硫原子和12个氧原子构成,则物质的化学式为Cr2(SO4)3;产生的SO2可用氢氧化钠溶液来吸收,以减少对环境的污染.
答案:
(1)混合物;塑料;
(2)防止砝码生锈;
(3)强;Cr2(SO4)3;碱.
点评 此题考查各种金属的物理性质和金属活动性顺序表.此题很简单,已在考察基础知识的运用.学生应熟悉物质的性质及物质之间的反应来解答.

练习册系列答案
相关题目
18.下列推断正确的是( )
| A. | 在加压条件下,6000L 氧气可装入容积为 40L 的钢瓶中,由此推断氧气分子变小了 | |
| B. | 蔗糖在热水中的溶解速度更快,由此推断在受热情况下分子运动速率加快 | |
| C. | 中和反应生成盐和水,由此推断生成盐和水的反应一定是中和反应 | |
| D. | 碱能使酚酞试液变红,由此推断能使酚酞试液变红的物质一定是碱 |
11. 中国中医研究院终身研究员兼首席研究员,屠呦呦经过多年研究发现了新型抗疟药--青蒿素和双氢青蒿素,因此成为中国获得诺贝尔医学奖的第一人.下列有关青蒿素(化学式C15H22O5)的说法正确的是( )
中国中医研究院终身研究员兼首席研究员,屠呦呦经过多年研究发现了新型抗疟药--青蒿素和双氢青蒿素,因此成为中国获得诺贝尔医学奖的第一人.下列有关青蒿素(化学式C15H22O5)的说法正确的是( )
 中国中医研究院终身研究员兼首席研究员,屠呦呦经过多年研究发现了新型抗疟药--青蒿素和双氢青蒿素,因此成为中国获得诺贝尔医学奖的第一人.下列有关青蒿素(化学式C15H22O5)的说法正确的是( )
中国中医研究院终身研究员兼首席研究员,屠呦呦经过多年研究发现了新型抗疟药--青蒿素和双氢青蒿素,因此成为中国获得诺贝尔医学奖的第一人.下列有关青蒿素(化学式C15H22O5)的说法正确的是( )| A. | 青蒿素是由碳、氢、氮三种元素组成的有机化合物 | |
| B. | 青蒿素是由多原子分子构成的物质 | |
| C. | 青蒿素中质子数小于中子数 | |
| D. | 青蒿素分子是由15个碳原子、22个氢原子和5个氧原子构成 |
18.实验室常制取某些气体,请你根据所学知识回答下列问题:

(1)实验室制取氧气时,若用如图装置收集氧气,则气体应从b进(填“a”或“b”).
(2)小明取一定浓度的盐酸与石灰石反应制取气体,反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O;将生成的气体通入澄清石灰水中,未见变浑浊.为探究其原因,进行了如下过程:
【作出猜想】A.石灰水已经完全变质; B.气体中有挥发出来的HCl气体.
【实验探究】
①取少量石灰水于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到溶液变红色.于是排除了猜想A,你认为排除猜想A的理由是酚酞溶液变红,说明溶液中存在碱性物质.
②小明想探究所得气体中是否有挥发出来的HCl气体,设计如下实验.请你帮他完成实验,填写以下表格:
【实验思考】要除去所制得的二氧化碳气体中的HCl气体,一般选用碳酸氢钠溶液.
【拓展延伸】假如用100克14.6%的稀盐酸和足量的石灰石反应,反应停止后,问可以收集的气体的质量为多少?

(1)实验室制取氧气时,若用如图装置收集氧气,则气体应从b进(填“a”或“b”).
(2)小明取一定浓度的盐酸与石灰石反应制取气体,反应的化学方程式为CaCO3+2HCl=CaCl2+CO2↑+H2O;将生成的气体通入澄清石灰水中,未见变浑浊.为探究其原因,进行了如下过程:
【作出猜想】A.石灰水已经完全变质; B.气体中有挥发出来的HCl气体.
【实验探究】
①取少量石灰水于试管中,并向试管中滴加几滴无色酚酞试液,振荡,观察到溶液变红色.于是排除了猜想A,你认为排除猜想A的理由是酚酞溶液变红,说明溶液中存在碱性物质.
②小明想探究所得气体中是否有挥发出来的HCl气体,设计如下实验.请你帮他完成实验,填写以下表格:
| 实验步骤 | 实验现象 | 实验结论 |
| 将生成的气体通入AgNO3溶液中 | 产生白色沉淀 | 气体中有HCl |
【拓展延伸】假如用100克14.6%的稀盐酸和足量的石灰石反应,反应停止后,问可以收集的气体的质量为多少?
8.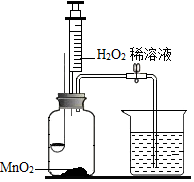 用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.
用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.
已知:白磷的着火点为 40℃.
(1)H2O2稀溶液与MnO2接触时发生反应的化学方程式为2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;.
(2)实验中,推入H2O2溶液前,燃烧匙和水中的白磷均不燃烧,原因分别是温度未达着火点、未与氧气接触; 推入H2O2溶液后,观察的现象是D(填序号).
A.燃烧匙内白磷、水中白磷均燃烧 B.燃烧匙内白磷、水中白磷均不燃烧
C.燃烧匙内白磷燃烧、水中白磷不燃烧 D.燃烧匙内白磷不燃烧、水中白磷燃烧
(3)实验2中,推入H2O2溶液后,观察到硫磺燃烧得更剧烈,发出蓝紫色 火焰,由此得出氧气的性质是支持燃烧;硫磺熄灭后冷却一段时间,烧杯中的部分溶液流入集气瓶.该实验中,集气瓶内压强的变化过程是先变大后变小.
 用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.
用如图所示装置,在常温下,分别进行研究燃烧条件和研究氧气性质的实验.已知:白磷的着火点为 40℃.
| 内容 步骤 | 【实验 1】研究燃烧条件 | 【实验 2】研究氧气性质 |
Ⅰ | 烧杯中盛有 80℃的热水,分别在燃烧匙和烧杯中导管口放置一小块白磷,塞紧瓶塞 | 烧杯中盛有 NaOH 溶液,燃烧匙中放入硫磺,点燃硫后迅速将燃烧匙伸入瓶中,塞紧瓶塞 |
| Ⅱ | 推入适量H2O2溶液 | 推入适量H2O2溶液 |
(2)实验中,推入H2O2溶液前,燃烧匙和水中的白磷均不燃烧,原因分别是温度未达着火点、未与氧气接触; 推入H2O2溶液后,观察的现象是D(填序号).
A.燃烧匙内白磷、水中白磷均燃烧 B.燃烧匙内白磷、水中白磷均不燃烧
C.燃烧匙内白磷燃烧、水中白磷不燃烧 D.燃烧匙内白磷不燃烧、水中白磷燃烧
(3)实验2中,推入H2O2溶液后,观察到硫磺燃烧得更剧烈,发出蓝紫色 火焰,由此得出氧气的性质是支持燃烧;硫磺熄灭后冷却一段时间,烧杯中的部分溶液流入集气瓶.该实验中,集气瓶内压强的变化过程是先变大后变小.
15.下列变化属于化学变化的是( )
| A. | 淀粉消化成葡萄糖 | B. | 石油中分离得汽油和柴油 | ||
| C. | 浓盐酸敞口有白雾 | D. | 奶茶杯口塑料膜受热熔化封口 |
12.在一次化学实验中,同学们将饱和硫酸铜溶液逐滴加到5mL饱和氢氧化钠溶液中,观察到以下异常实验现象:
在实验①中同学们根据所学初中化学知识判断蓝色沉淀是氢氧化铜,请你写出生成蓝色沉淀的化学方程式CuSO4+2NaOH═Cu(OH)2↓+Na2SO4.
实验①中蓝色沉淀为什么消失?同学们继续进行如下探究.
【查阅资料】I.氢氧化铜在温度70℃-80℃时可分解生成氧化铜;
II.四羟基合铜酸钠[Na2Cu(OH)4]溶于水,溶液呈亮蓝色.
【猜想与讨论】小陶认为蓝色沉淀消失可能是氢氧化铜发生了分解.其他同学一致否定了他的猜测,理由是如分解则会生成氧化铜是黑色固体,而蓝色沉淀消失后是形成亮蓝色溶液.
同学们交流讨论后,提出以下两种猜想.
猜想一:少许氢氧化铜可溶于足量水中.
猜想二:氢氧化铜可在足量氢氧化钠浓溶液中溶解,溶液呈亮蓝色.
【实验探究】同学们用氢氧化铜粉末(其它试剂可任选)设计如下实验.请填写表中空格.
【结论与反思】(1)根据实验,并进一步查阅资料知道,氢氧化铜在氢氧化钠溶液中溶解生成Na2Cu(OH)4,反应的化学方程式是2NaOH+Cu(OH)2=Na2Cu(OH)4.
(2)根据实验可知饱和硫酸铜溶液与饱和氢氧化钠溶液的反应是放热反应,依据的实验现象是蓝色沉淀逐渐变为黑色.
(3)写出氢氧化铜受热分解生成黑色固体的化学方程式Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O.
| 实验序号 | 滴加CuSO4溶液的量 | 实验现象 |
| ① | 第1~6滴 | 有蓝色沉淀,但振荡后沉淀消失,形成亮蓝色溶液 |
| ② | 第7~9滴 | 产生蓝色沉淀,且沉淀逐渐增多,振荡后沉淀不消失,很快沉淀逐渐变黑色 |
实验①中蓝色沉淀为什么消失?同学们继续进行如下探究.
【查阅资料】I.氢氧化铜在温度70℃-80℃时可分解生成氧化铜;
II.四羟基合铜酸钠[Na2Cu(OH)4]溶于水,溶液呈亮蓝色.
【猜想与讨论】小陶认为蓝色沉淀消失可能是氢氧化铜发生了分解.其他同学一致否定了他的猜测,理由是如分解则会生成氧化铜是黑色固体,而蓝色沉淀消失后是形成亮蓝色溶液.
同学们交流讨论后,提出以下两种猜想.
猜想一:少许氢氧化铜可溶于足量水中.
猜想二:氢氧化铜可在足量氢氧化钠浓溶液中溶解,溶液呈亮蓝色.
【实验探究】同学们用氢氧化铜粉末(其它试剂可任选)设计如下实验.请填写表中空格.
| 实验序号 | 实验方法与操作 | 实验现象 | 结论 |
| ③ | 将少许Cu(OH)2粉末加到5mL蒸馏水中,充分振荡 | 沉淀不溶解,液体仍为无色 | 猜想一错误 |
| ④ | 将少许Cu(OH)2粉末加入到足量氢氧化钠浓溶液中,充分振荡 | 固体溶解,溶液呈亮蓝色 | 猜想二正确 |
(2)根据实验可知饱和硫酸铜溶液与饱和氢氧化钠溶液的反应是放热反应,依据的实验现象是蓝色沉淀逐渐变为黑色.
(3)写出氢氧化铜受热分解生成黑色固体的化学方程式Cu(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CuO+H2O.
 如图是某工业盐产品质量指标.为了测定该工业盐中氯化钠的质量分数,取100g该工业盐进行实验:①测得水的质量分数为3.36%;②用碳酸钠来测定杂质氯化钡的质量时,得到0.985g沉淀.(碳酸钠与氯化钡反应的化学方程式:
如图是某工业盐产品质量指标.为了测定该工业盐中氯化钠的质量分数,取100g该工业盐进行实验:①测得水的质量分数为3.36%;②用碳酸钠来测定杂质氯化钡的质量时,得到0.985g沉淀.(碳酸钠与氯化钡反应的化学方程式:
