题目内容
5. 在学习盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行了一系列的研究.
在学习盐的性质时,某组同学将碳酸钠溶液和一瓶标签破损的溶液M(如图)进行反应,有白色沉淀产生,过滤后得到澄清滤液.同学们对该实验进行了一系列的研究.探究一 M溶液中的溶质是什么?
(1)【提出猜想】该组同学认为M溶液的溶质有两种可能:
①是Ca(OH)2,②是CaCl2.
【收集资料】CaCl2水溶液呈中性.
(2)【设计实验】同学们设计了如下方案并进行实验:
| 实验操作 | 实验现象 | 实验结论 |
| 取少量M溶液于 试管中,向其中滴加酚酞溶液. | 酚酞溶液变红色. | 猜想①正确,碳酸钠与其反应的化学 方程为Na2CO3+Ca(OH)2=CaCO3↓+2NaOH. |
【提出猜想】猜想一:NaOH和Na2CO3;猜想二:NaOH和Ca(OH)2;猜想三:NaOH
(3)【实验验证】同学们针对“猜想一”进行了如下实验:
| 实验步骤 | 实验现象 | 实验结论 |
| 取样于试管中,滴入几滴稀盐酸 | 没有气体产生. | “猜想一”不成立 |
分析 根据碳酸钠的性质和部分标签的内容、命名进行猜想;根据氢氧化钙或氯化钙溶液的酸碱性结合实验结论分析现象;根据碳酸钠与氢氧化钙的反应产物及反应的程度进行猜想;根据氢氧化钙、碳酸钠与氯化钙、碳酸钠的反应现象结合实验结论分析.
解答 解:探究一(1)根据标签的残留化学式以及名称可以猜想可能是氢氧化钙,故填:Ca(OH)2;
(2)猜想①正确,则是氢氧化钙,氢氧化钙呈碱性,能使酚酞试液变红,故可以加入酚酞试液,碳酸钠能与氢氧化钙反应生成碳酸钙陈德华氢氧化钠,故填:酚酞溶液;酚酞溶液变红色;Na2CO3+Ca(OH)2=CaCO3↓+2NaOH;
探究二 根据氢氧化钙与碳酸钠的反应程度,可以猜测剩余的滤液中的溶质可能是氢氧化钠和氢氧化钙,故填:NaOH和Ca(OH)2;
(3)猜想一不成立,则加入盐酸没有气体产生,但是由于加入的是几滴盐酸,可能是没有与碳酸钠反应,故结论不正确,故填:没有气体产生;不正确;溶液中氢氧化钠能与加入的少量盐酸反应,即使溶液中有Na2CO3溶液也可能不产生气体.
点评 本考点探究了物质的组成成分,解答本题关键是在分析过滤后溶液中溶质成分时不仅要看生成物中溶质,还要看反应物是否有剩余,检验钙离子可以用碳酸根离子来考虑,检验碳酸根离子,可以用钙离子检验.本考点主要出现在实验题中.

练习册系列答案
 名校通行证有效作业系列答案
名校通行证有效作业系列答案
相关题目
18. 实验室有一变质的氢氧化钠样品(样品中只含碳酸钠杂质,且成分均匀),为测量样品中Na2CO3的质量分数,小明进行了如下实验.
实验室有一变质的氢氧化钠样品(样品中只含碳酸钠杂质,且成分均匀),为测量样品中Na2CO3的质量分数,小明进行了如下实验.
①取质量、大小相同的3个烧杯,分别加入一定质量分数的稀盐酸100克;
②向上述3个烧杯中分别加入3份质量不同的样品;
③充分反应后,再用电子天平称量烧杯及烧杯内物质的总质量(假设产生的气体完全逸出).实验数据如下:
已知实验中发生的化学反应:NaOH+HCl═NaCl+H2O
Na2CO3+2HCl═2NaCl+H2O+CO2↑
(1)分析表中数据,写出判断实验二中的样品已完全反应的理由:实验三产生的气体的质量为150g+12g-158.7g=3.3g,实验二产生的气体的质量为150g+8g-155.8g=2.2g,实验三产生的气体的质量大于实验二,所以实验二中稀盐酸有剩余,8g样品已完全反应..
(2)表中的m值为152.9.
(3)根据实验二中的数据计算样品中Na2CO3的质量分数.
 实验室有一变质的氢氧化钠样品(样品中只含碳酸钠杂质,且成分均匀),为测量样品中Na2CO3的质量分数,小明进行了如下实验.
实验室有一变质的氢氧化钠样品(样品中只含碳酸钠杂质,且成分均匀),为测量样品中Na2CO3的质量分数,小明进行了如下实验.①取质量、大小相同的3个烧杯,分别加入一定质量分数的稀盐酸100克;
②向上述3个烧杯中分别加入3份质量不同的样品;
③充分反应后,再用电子天平称量烧杯及烧杯内物质的总质量(假设产生的气体完全逸出).实验数据如下:
| 实验一 | 实验二 | 实验三 | |
| 反应前稀盐酸+烧杯质量(克) | 150 | 150 | 150 |
| 反应前固体样品质量(克) | 4 | 8 | 12 |
| 反应后烧杯内物质+烧杯质量(克) | m | 155.8 | 158.7 |
Na2CO3+2HCl═2NaCl+H2O+CO2↑
(1)分析表中数据,写出判断实验二中的样品已完全反应的理由:实验三产生的气体的质量为150g+12g-158.7g=3.3g,实验二产生的气体的质量为150g+8g-155.8g=2.2g,实验三产生的气体的质量大于实验二,所以实验二中稀盐酸有剩余,8g样品已完全反应..
(2)表中的m值为152.9.
(3)根据实验二中的数据计算样品中Na2CO3的质量分数.
19.下列说法中不正确的是( )
| A. | 大米主要成分是淀粉,淀粉遇碘化钾溶液变蓝色 | |
| B. | 鸡蛋清中加入饱和硫酸铵溶液,有白色沉淀 | |
| C. | 油脂不溶于水,易溶于汽油等有机溶剂 | |
| D. | 新鲜蔬菜、水果中含有丰富的维生素C |
16.下列实验操作正确的是( )
| A. |  稀释浓硫酸 | B. |  滴加液体 | C. |  取固体药品 | D. |  点燃酒精灯 |
10.以电石渣[主要成分Ca(OH)2和CaCO3]为原料制备KClO3的流程如图.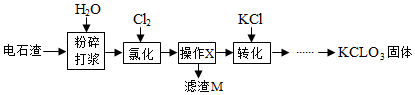
查阅资料:在75℃左右,氯化步骤中氯气转化成Ca(ClO3)2时发生一系列的反应,其中Cl2与Ca(OH)2反应的总化学方程式可表示为:
6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+aH2O
(1)氯化前,先将电石渣粉碎的目的是增大反应物的接触面积,加快反应速率.
(2)氯化步骤中所得产物氯酸钙Ca(ClO3)2中Cl的化合价为+5价,a数值为6.
(3)操作X为过滤.转化步骤中Ca(ClO3)2与KCl反应生成KClO3的化学方程式为Ca(ClO3)2+2KCl=2KClO3+CaCl2.(相关物质的溶解度见下表)
(4)对滤渣M的成分进行探究
【提出问题】滤渣M中除了电石渣原有的不溶性杂质外,还含有什么物质?
【猜想假设】①CaCO3; ②Ca(OH)2; ③CaCO3和Ca(OH)2.
【实验验证】

查阅资料:在75℃左右,氯化步骤中氯气转化成Ca(ClO3)2时发生一系列的反应,其中Cl2与Ca(OH)2反应的总化学方程式可表示为:
6Ca(OH)2+6Cl2=Ca(ClO3)2+5CaCl2+aH2O
(1)氯化前,先将电石渣粉碎的目的是增大反应物的接触面积,加快反应速率.
(2)氯化步骤中所得产物氯酸钙Ca(ClO3)2中Cl的化合价为+5价,a数值为6.
(3)操作X为过滤.转化步骤中Ca(ClO3)2与KCl反应生成KClO3的化学方程式为Ca(ClO3)2+2KCl=2KClO3+CaCl2.(相关物质的溶解度见下表)
| 物质 | Ca(ClO3)2 | CaCl2 | KClO3 | KCl |
| T℃时溶解度/g | 209.0 | 74.5 | 7.3 | 34.2 |
【提出问题】滤渣M中除了电石渣原有的不溶性杂质外,还含有什么物质?
【猜想假设】①CaCO3; ②Ca(OH)2; ③CaCO3和Ca(OH)2.
【实验验证】
| 实验步骤 | 实验现象 | 结论 |
| 步骤1:取少量滤渣M加入盛水的小烧杯中,搅拌,静置后先加入几滴无色酚酞试液; | 观察到溶液变红色现象 | 猜想①不正确 |
| 步骤2:向小烧杯中继续加入足量的稀盐酸 | 观察到固体溶解并有气泡产生现象 | 猜想③正确 |
17.联合国确定2017年“世界水日”的宣传主题是“Wastewater”(废水).我市某化工厂排放的废水中含有少量的NaOH、Na2SO4,按环保要求需要把废水处理成pH=7且水中只含有少量NaCl才能排放.则工厂废水处理需要加入的一组物质是( )
| A. | MgSO4、NaCl | B. | H2SO4、MgCl2 | C. | H2SO4、Ba(NO3)2 | D. | BaCl2、HCl |
14.下列四个图象中,能正确表示对应变化关系的是( )
| A. |  加热一定量氯酸钾固体 | |
| B. |  向接近饱和的硝酸钾溶液中加入硝酸钾 | |
| C. |  向一定量稀硫酸中加水 | |
| D. |  将等质量铁、锌分别与足量稀盐酸混合 |
 ,在元素周期表中镓元素位于第四周期,镓原子失去电子形成离子的符号可表示为Ga3+.
,在元素周期表中镓元素位于第四周期,镓原子失去电子形成离子的符号可表示为Ga3+. B.
B. C.
C. D.
D.