题目内容
19.分类、类比是提高学习效率的常用方法(1)将下列标志自拟分类标准分成两类.

其中一个分类标准是与燃烧爆炸有关的标志;包含的标志序号有①④⑥
(2)如图四种元素的原子结构示意图,回答下列问题;
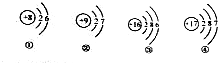
小齐同学将①和③分为一组,他分组的理由是最外层电子数相同
(3)通过课外阅读发现非金属元素的化学性质与核外电子排列关系密切,非金属元素原子核外电子层数越少,最外层电子数越多.在化学反应中越容易得到电子,化学性质越活泼,在查阅资料又得知结论:Cl2、F2是氯氟两种元素组成的两种非金属单质.经过类比分析,发现非金属单质与盐发生的置换反应跟金属与盐发生的置换反应有类似的规律.请你用一个化学方程式来证明二者活动性强弱F2+2NaCl=2NaF+Cl2.
分析 (1)根据化学图标的意义进行分类;
(2)根据最外层电子数决定元素的化学性质来分析;
(3)根据金属跟盐的置换反应规律是活动性强的金属置换活动性较弱的金属,非金属跟盐反应也有这种规律,故活动性强的非金属单质置换活动性较弱的非金属单质.
解答 解:(1)据图可以看出,①④⑥都是与燃烧爆炸有关的标志,②③⑤与节能环保有关,故填:与燃烧爆炸有关的标志;①④⑥;
(2)①与③、②与④的最外层电子数相同,化学性质相似;故填:最外层电子数相同;
(3)活动性强的非金属单质置换活动性较弱的非金属单质.可得活动性由强到弱的顺序为F2>Cl2>Br2>I2 所以F2+2NaCl=2NaF+Cl2这个反应能进行.故填:F2+2NaCl=2NaF+Cl2.
点评 本题考查了化学图标的含义、微粒结构示意图的意义,掌握题目所给信息并灵活运用所学知识是解答本题的关键.

练习册系列答案
 期末集结号系列答案
期末集结号系列答案
相关题目
10.已知某粒子的结构示意图为 ,则x的值可能为( )
,则x的值可能为( )
 ,则x的值可能为( )
,则x的值可能为( )| A. | 3 | B. | 11 | C. | 19 | D. | 17 |
4.化学活动小组同学为探究某赤铁矿石样品的纯度,先后进行了三次实验,实验数据如表:
根据上述实验数据,试回答下列问题:(赤铁矿石样品中所含杂质不与其它任何物质反应也不溶于水)
(1)实验中发生反应的化学方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)此赤铁矿石样品的纯度为:80%;
(3)根据已知条件列出求解第三次实验中稀硫酸中参加反应的硫酸质量(X)的比例式:
(4)如果用98%的浓硫酸配制第二次实验所用的稀硫酸,需加水的质量为:370g;
(5)将第三次实验后烧杯内物质过滤,向所得的不饱和溶液中加入84g的水后,则所得溶液的溶质质量分数为9.6%;
(6)如果将第三次实验中的剩余固体经过洗涤,干燥,并用足量的一氧化碳进行还原,则最终可得到固体的质量为11g.
| 实验次数 | 第一次 | 第二次 | 第三次 |
| 所取赤铁矿石样品的质量/g | 20 | 20 | 30 |
| 所加稀硫酸的质量/g | 500 | 400 | 300 |
| 烧杯内剩余固体的质量/g | 4 | 4 | 14 |
(1)实验中发生反应的化学方程式为:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O;
(2)此赤铁矿石样品的纯度为:80%;
(3)根据已知条件列出求解第三次实验中稀硫酸中参加反应的硫酸质量(X)的比例式:
(4)如果用98%的浓硫酸配制第二次实验所用的稀硫酸,需加水的质量为:370g;
(5)将第三次实验后烧杯内物质过滤,向所得的不饱和溶液中加入84g的水后,则所得溶液的溶质质量分数为9.6%;
(6)如果将第三次实验中的剩余固体经过洗涤,干燥,并用足量的一氧化碳进行还原,则最终可得到固体的质量为11g.
1.下列是我们日常生活中接触到的物质,其中属于纯净物的是( )
| A. | 碘酒 | B. | 蒸馏水 | C. | 可乐饮料 | D. | 盐酸 |
2.下列关于CO2、SO2、O2等三种物质的组成叙述中正确的是( )
| A. | 都含有氧气 | B. | 都含有2个氧原子 | C. | 都含有氧分子 | D. | 都含有氧元素 |

 A、B、C、D、E、F为初中化学常见物质,A、B两溶液发生中和反应,固体C常用于改良酸性土壤,且C和D反应可制得B;E、F的物质类别相同,且F能与A溶液发生反应,已知上述物质间存在如图所示的关系(“→”表示转化关系,“-”表示反应关系).
A、B、C、D、E、F为初中化学常见物质,A、B两溶液发生中和反应,固体C常用于改良酸性土壤,且C和D反应可制得B;E、F的物质类别相同,且F能与A溶液发生反应,已知上述物质间存在如图所示的关系(“→”表示转化关系,“-”表示反应关系).