题目内容
13.某氯化钠溶液中含有少量的氯化钡和氢氧化钠溶液杂质,它们的质量比为13:10.欲将两种杂质同时除去,得到纯净的氯化钠溶液,可选用的试剂组合是( )| A. | 盐酸和硫酸溶液,其溶质的质量比为146:98 | |
| B. | 盐酸和硫酸钠溶液,其质量比为73:71 | |
| C. | 硫酸和硫酸钠溶液,其质量比为98:71 | |
| D. | 硫酸和硫酸镁溶液,其溶质的质量比为49:60 |
分析 本题属于除杂质题,还包含了有关的计算.一般的除杂质题必须同时满足两个条件:①加入的试剂只能与杂质反应,不能与原物质反应②反应时不能加入新的杂质.氯化钠溶液中含有少量的氯化钡溶液杂质,可以用硫酸(或硫酸钠)除去;含有的氢氧化钠溶液杂质,可以用稀盐酸除去,还要注意滴加试剂的先后顺序.再根据有关化学方程式的计算,计算出所需要的质量比即可.
解答 解:A、设硫酸的质量为x;生成氯化氢的质量为y;氢氧化钠共需要盐酸的质量为z
BaCl2+H2SO4=BaSO4↓+2HCl NaOH+HCl=NaCl+H2O
208 98 73 40 36.5
13g x y 10g z
$\frac{208}{13g}$=$\frac{98}{x}$=$\frac{73}{y}$
$\frac{40}{10g}$=$\frac{36.5}{z}$
x=6.125g
y=4.5625g
z=9.125g
z-y=9.125g-4.5625g=4.5625g
因此盐酸和硫酸溶液的溶质的质量比为:$\frac{4.5625g}{6.125g}$,故A错误;
B、设氢氧化钠需要盐酸溶质的质量为x,硫酸钠的质量为y
NaOH+HCl=NaCl+H2O BaCl2+Na2SO4=BaSO4↓+2NaCl
40 36.5 208 142
10g x 13g y
$\frac{40}{10g}$=$\frac{36.5}{x}$
$\frac{208}{13g}$=$\frac{142}{y}$
x═9.125g
y═8.875g
因此,盐酸和硫酸钠溶液的溶质的质量比为:$\frac{9.125g}{8.875g}$=$\frac{73}{71}$,故B正确;
C、用硫酸和硫酸钠溶液时,也会加入新的杂质硫酸钠,故C错误;
D、用硫酸和硫酸镁溶液,会加入新的杂质氯化镁,故D错误.
故选:B.
点评 本考点属于物质的除杂或净化的探究,又结合了根据化学方程式的计算,属于难度比较大的题,也是学生经常出错的题型.综合性比较强,要牢记除杂质的条件,并认真分析,综合把握,从而突破本难点.

| A. | 酒精做燃料:C2H5OH+3O2$\frac{\underline{\;点燃\;}}{\;}$2CO2+3H2O 氧化反应 | |
| B. | 电解水制取氢气:2H2O$\frac{\underline{\;电解\;}}{\;}$2H2↑+O2↑分解反应 | |
| C. | 敞口放置的氢氧化钠固体变质:2NaOH+CO2=Na2CO3+H2O 复分解反应 | |
| D. | 比较铜和银的活动性:Cu+2AgNO3=Cu(NO3)2+2Ag 置换反应 |
| 选项 | 待提纯的物质 | 除去杂质的方法 |
| A | 金(铁粉) | 加入足量稀盐酸、过滤、洗涤、干燥 |
| B | 氯化钙溶液(碳酸钠) | 加入适量的稀盐酸,过滤 |
| C | H2O(有异味的物质) | 活性炭,吸附 |
| D | 氧化钙(石灰石) | 高温煅烧 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 1g | B. | 3.725g | C. | 0.797g | D. | 2.836g |
 如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线.下列说法正确的是( )
如图是甲、乙、丙三种固体物质(均不含结晶水)的溶解度曲线.下列说法正确的是( )| A. | t1℃时甲、丙物质溶液中溶质质量分数一定相等 | |
| B. | 将t2℃时甲、乙、丙三种物质的饱和溶液分别降温至t1℃,所得溶液的溶质质量分数:乙>甲>丙 | |
| C. | t2℃时甲、乙、丙的饱和溶液分别恒温蒸发等量的水,析出溶质的质量:甲>乙>丙 | |
| D. | 若使点a的甲溶液60g,转化到点b,至少应加入30g甲固体 |
| 实验一 观察固体表面 | 实验二 向两块固体表面滴加稀盐酸 | 实验三 振荡3个塑料瓶 |
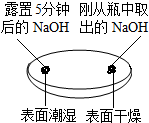 | 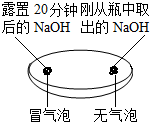 | 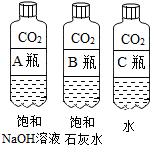 |
(2)实验三中可观察到三个软塑料瓶变瘪的程度大小为A>B>C,对比A瓶与C(选填“B”或“C”)瓶的实验现象可证明CO2能与NaOH发生反应.
(3)同学们设计如下两种方案鉴别氢氧化钠溶液与氢氧化钙两种饱和溶液.
| 实验一 | 实验二 | 分析 |
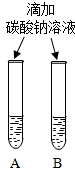 | 微热(不考虑水分蒸发)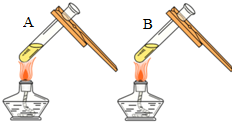 | 两种方案中均观察到A试管内出现白色浑浊,则A中溶液为饱和氢氧化钙溶液;;方案二的设计原理是氢氧化钙的溶解度随温度升高而减小,氢氧化钠的溶解度随温度升高而增大. |

【提出问题】氢氧化钠中含有什么杂质?
【查阅资料】
①在化工生产中,原料往往不能完全转化为产品.
②工业上制取NaOH的反应原理是:2NaCl+2H2O$\stackrel{通电}{→}$2NaOH+H2↑+Cl2↑,然后蒸发溶剂获得NaOH固体.
③碱性的Na2CO3溶液与中性的CaCl2溶液发生复分解反应.
【提出猜想】氢氧化钠中含有的杂质为碳酸钠和氯化钠.提出上述猜想的理由是原料中的NaCl未完全反应,氢氧化钠与空气中的二氧化碳反应生成碳酸钠.
【进行实验】取固体于试管中,加水溶解并向溶液中加入过量稀盐酸
【实验结论】溶液中有明显现象,证明杂质中一定含有碳酸钠.
【反思评价】该同学想进一步证明固体中的氢氧化钠,实验方案是取少量固体于试管中加水溶解,加入过量的氯化钙溶液使沉淀完全,静置后向上层清液中滴加酚酞溶液,溶液变红,则固体中含有氢氧化钠.
(5)某碳酸钠样品中含有少量氯化钠.现称量11g该样品放入烧杯中,然后加入一定量溶质的质量分数为14.6%的稀盐酸,至恰好完全反应,去除溶液中的水分,最终得到12.1g氯化钠固体.计算:
①碳酸钠样品中碳酸钠的质量;
②反应后所得溶液中溶质的质量分数.(结果精确到0.1%)
 .
.