题目内容
8.我国西部大部分山区的许多村庄,仍以饮用未经任何处理的地表水为主,这些地表水受到不同程度的污染,对山区群众的身体健康造成不利影响.目前国务院和各级政府投入大量资金,采取积极措施为这些村庄建水厂、安装自来水管道,让群众喝上清洁、卫生的水.(1)硬水可用肥皂水来区分.硬水中含有较多可溶性钙、镁化合物,硬水会给生活和生产带来许多麻烦.生活中可用加热煮沸来降低水的硬度.
(2)硬水在加热或久置时,会产生水垢[主要成分是Mg(OH)2和CaCO3],生活中可用适量稀盐酸除去热水瓶壁上的水垢,写出有关反应的化学方程式:Mg(OH)2+2HCl═MgCl2+2H2O、CaCO3+2HCl═CaCl2+H2O+CO2↑.
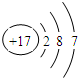
(3)自来水生产过程中,可用方法除去水中不溶性杂质,同时还必须进行消毒杀菌.ClO2是一种新型的自来水消毒剂,其中氯元素与氧元素的质量比为71:64,氯的原子结构示意图为
 .
.(4)水通电分解的化学方程式2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
分析 (1)根据硬水与软水的检验方法、转化方法进行分析解答;
(2)根据水垢的主要成分、酸的化学性质进行分析,写出反应的化学方程式即可;
(3)水中不溶性杂质可用过滤的方法除去;元素的质量比为各种元素的相对原子质量和的比;
(4)根据题目中的反应物、生成物和反应条件,依据化学方程式的书写方法,可以写出水电解的化学方程式.
解答 解:(1)硬水与软水可用肥皂水来区分,把等量的肥皂水分别滴加到盛有等量的软水、硬水的烧杯中,搅拌,产生泡沫较多的是软水,产生泡沫较少的是硬水;生活中可以采用加热煮沸的方法降低水的硬度,
故答案为:肥皂水;加热煮沸;
(2)水垢的主要成分是Mg(OH)2和CaCO3,均能与稀盐酸反应;Mg(OH)2和稀盐酸反应生成氯化镁和水,反应的化学方程式为:Mg(OH)2+2HCl=MgCl2+2H2O;碳酸钙与稀盐酸反应生成氯化钙、水、二氧化碳,反应的化学方程式为:CaCO3+2HCl=CaCl2+H2O+CO2↑,
故答案为:Mg(OH)2+2HCl═MgCl2+2H2O;CaCO3+2HCl═CaCl2+H2O+CO2↑;
(3)自来水生产过程中,除去水中不溶性杂质可用过滤方法;氯氧两元素的质量比=35.5:(16×2)=71:64;氯元素的原子结构示意图为 .
.
故答案为:过滤;71:64; .
.
(4)水通电分解的化学方程式为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑;
故答案为:2H2O$\frac{\underline{\;通电\;}}{\;}$2H2↑+O2↑.
点评 本题考查硬水与软水的检验方法、转化方法和有关化学式的计算等,难度不大,注意应加强基础知识的学习.

练习册系列答案
相关题目
19. 如图是A、B两种物质的溶解度曲线,下列说法不正确的是( )
如图是A、B两种物质的溶解度曲线,下列说法不正确的是( )
 如图是A、B两种物质的溶解度曲线,下列说法不正确的是( )
如图是A、B两种物质的溶解度曲线,下列说法不正确的是( )| A. | A物质的溶解度随温度升高而增大 | |
| B. | t2℃时,A物质的溶解度大于B物质的溶解度 | |
| C. | A的饱和溶液温度越高,溶质质量分数越大 | |
| D. | t1℃时,A、B两种物质饱和溶液的质量分数为25% |
13.某氯化钠溶液中含有少量的氯化钡和氢氧化钠溶液杂质,它们的质量比为13:10.欲将两种杂质同时除去,得到纯净的氯化钠溶液,可选用的试剂组合是( )
| A. | 盐酸和硫酸溶液,其溶质的质量比为146:98 | |
| B. | 盐酸和硫酸钠溶液,其质量比为73:71 | |
| C. | 硫酸和硫酸钠溶液,其质量比为98:71 | |
| D. | 硫酸和硫酸镁溶液,其溶质的质量比为49:60 |
17.下列指定反应的化学方程式正确的是( )
| A. | 酸雨的形成原理:CO2+H2O=H2CO3 | |
| B. | 利用赤铁矿炼铁:Fe3O4+4CO $\frac{\underline{\;高温\;}}{\;}$3Fe+4CO2 | |
| C. | 不能用铁制容器配制波尔多液:2Fe+3CuSO4=Fe2(SO4)3+3Cu | |
| D. | 铜绿的形成:2Cu+O2+H2O+CO2═Cu2(OH)2CO3 |
 根据如图的原子结构示意图回答下列问题.
根据如图的原子结构示意图回答下列问题. 向一定质量、一定溶质质量分数的稀盐酸中逐滴加入某碳酸钠溶液.实验过程中,产生气体质量与加入碳酸溶液的质量关系如图所示,试计算:
向一定质量、一定溶质质量分数的稀盐酸中逐滴加入某碳酸钠溶液.实验过程中,产生气体质量与加入碳酸溶液的质量关系如图所示,试计算: