题目内容
6.同学们运用对比的学习方法探究碱的性质.| 实验一 观察固体表面 | 实验二 向两块固体表面滴加稀盐酸 | 实验三 振荡3个塑料瓶 |
 |  | 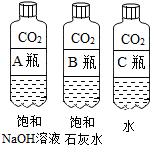 |
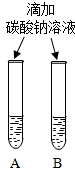
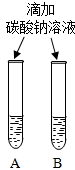
(2)实验三中可观察到三个软塑料瓶变瘪的程度大小为A>B>C,对比A瓶与C(选填“B”或“C”)瓶的实验现象可证明CO2能与NaOH发生反应.
(3)同学们设计如下两种方案鉴别氢氧化钠溶液与氢氧化钙两种饱和溶液.
| 实验一 | 实验二 | 分析 |
 | 微热(不考虑水分蒸发)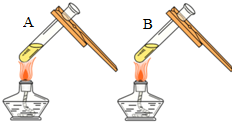 | 两种方案中均观察到A试管内出现白色浑浊,则A中溶液为饱和氢氧化钙溶液;;方案二的设计原理是氢氧化钙的溶解度随温度升高而减小,氢氧化钠的溶解度随温度升高而增大. |

【提出问题】氢氧化钠中含有什么杂质?
【查阅资料】
①在化工生产中,原料往往不能完全转化为产品.
②工业上制取NaOH的反应原理是:2NaCl+2H2O$\stackrel{通电}{→}$2NaOH+H2↑+Cl2↑,然后蒸发溶剂获得NaOH固体.
③碱性的Na2CO3溶液与中性的CaCl2溶液发生复分解反应.
【提出猜想】氢氧化钠中含有的杂质为碳酸钠和氯化钠.提出上述猜想的理由是原料中的NaCl未完全反应,氢氧化钠与空气中的二氧化碳反应生成碳酸钠.
【进行实验】取固体于试管中,加水溶解并向溶液中加入过量稀盐酸
【实验结论】溶液中有明显现象,证明杂质中一定含有碳酸钠.
【反思评价】该同学想进一步证明固体中的氢氧化钠,实验方案是取少量固体于试管中加水溶解,加入过量的氯化钙溶液使沉淀完全,静置后向上层清液中滴加酚酞溶液,溶液变红,则固体中含有氢氧化钠.
(5)某碳酸钠样品中含有少量氯化钠.现称量11g该样品放入烧杯中,然后加入一定量溶质的质量分数为14.6%的稀盐酸,至恰好完全反应,去除溶液中的水分,最终得到12.1g氯化钠固体.计算:
①碳酸钠样品中碳酸钠的质量;
②反应后所得溶液中溶质的质量分数.(结果精确到0.1%)
分析 (1)根据氢氧化钠的化学性质进行分析;
(2)根据二氧化碳与氢氧化钠、氢氧化钙、水的反应;
(3)根据氢氧化钠与氢氧化钙的溶解性进行分析;
(4)【提出猜想】根据氢氧化钠的制法和变质进行分析;
【反思评价】②根据氢氧根离子验证进行分析;
(5)①分析反应可发现,反应前为碳酸钠和氯化钠的混合物,而反应后得到固体为氯化钠,质量增加了12.1g-11g=1.1g,而该过程中是固体的质量增加了,所以可以根据差量法进行解答;
②反应后溶液的质量为反应前样品的质量+稀盐酸的质量-生成的二氧化碳的质量,然后结合溶液中溶质的质量分数的计算公式进行计算即可.
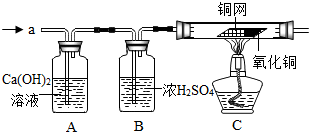
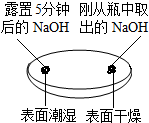
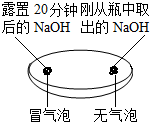
解答 解:(1)由上图实验一、二可知,氢氧化钠会吸收空气的 H2O、CO2,因此要密封保存;
(2)实验三中可观察到三个软塑料瓶变瘪的程度大小为A>B>C,A瓶内发生反应为二氧化碳与氢氧化钠溶液反应,对比A瓶与C瓶的实验现象可证明CO2能与NaOH发生反应;
(3)考虑氢氧化钠与氢氧化钙的溶解性:两种方案中均观察到A试管内出现白色浑浊,A中试剂为饱和氢氧化钙溶液;方案二的设计原理是利用了氢氧化钙的溶解度随温度升高而减少;氢氧化钠的溶解度随温度升高而升高;两者的溶解度受温度影响情况不同;
| 实验一 | 实验二 | 分析 |
 | 微热(不考虑水分蒸发)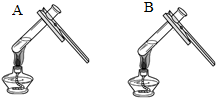 | 两种方案中均观察到A试管内出现白色浑浊,则A中溶液为饱和氢氧化钙溶液;方案二的设计原理是氢氧化钙的溶解度随温度升高而减小,氢氧化钠的溶解度随温度升高而增大 |
【反思评价】②要验证氢氧化钠,首先要排除碳酸钠的干扰,可以取少量固体于试管中加水溶解,加入过量的氯化钙溶液使沉淀完全,静置后向上层清液中滴加酚酞溶液,溶液变红,则固体中含有氢氧化钠;
(5)设碳酸钠的质量为x,
Na2CO3+2HCl═2NaCl+H2O+CO2↑
106 73 117 44
x $\frac{73x}{106}$ $\frac{117x}{106}$ $\frac{44x}{106}$
则11g-x+$\frac{117x}{106}$=12.1g
解得:x=10.6g
②反应后所得溶液中溶质的质量分数为:$\frac{12.1g}{11g+7.3g+14.6g-4.4g}$×100%≈21.4%
答:①碳酸钠样品中碳酸钠的质量为10.6g;
②反应后所得溶液中溶质的质量分数为21.4%.
故答案为:(1)H2O、CO2;(2)C;
(3)饱和氢氧化钙溶液;氢氧化钙的溶解度随温度升高而减小,氢氧化钠的溶解度随温度升高而增大;
| 实验一 | 实验二 | 分析 |
| 饱和氢氧化钙溶液;氢氧化钙的溶解度随温度升高而减小,氢氧化钠的溶解度随温度升高而增大 |
【反思评价】②取少量固体于试管中加水溶解,加入过量的氯化钙溶液使沉淀完全,静置后向上层清液中滴加酚酞溶液,溶液变红,则固体中含有氢氧化钠;
(5)①碳酸钠样品中碳酸钠的质量为10.6g;
②反应后所得溶液中溶质的质量分数为21.4%.
点评 熟练掌握二氧化碳和氢氧化钠、氢氧化钙的化学性质,能够根据物质的性质设计实验对物质进行鉴别,在学习中要注意培养自己设计实验的能力.

练习册系列答案
相关题目
13.某氯化钠溶液中含有少量的氯化钡和氢氧化钠溶液杂质,它们的质量比为13:10.欲将两种杂质同时除去,得到纯净的氯化钠溶液,可选用的试剂组合是( )
| A. | 盐酸和硫酸溶液,其溶质的质量比为146:98 | |
| B. | 盐酸和硫酸钠溶液,其质量比为73:71 | |
| C. | 硫酸和硫酸钠溶液,其质量比为98:71 | |
| D. | 硫酸和硫酸镁溶液,其溶质的质量比为49:60 |
14.随着我国二胎政策的放开,婴儿“尿不湿”的销量大大增加.婴儿“尿不湿”最关键的材料是聚丙烯酸钠,其吸水性是棉花、纸张的数十倍.它是由丙烯酸(C3H4O2)与氢氧化钠经过一系列的复杂反应而制得.下列有关丙烯酸的说法中,正确的是( )
| A. | 它是有机高分子化合物 | |
| B. | 其中氧元素与氢元素的质量比为9:1 | |
| C. | 其中碳元素的质量分数为51% | |
| D. | 一个丙烯酸分子由3个碳原子、4个氢原子和2个氧原子构成 |
11.下列除杂选用试剂正确的是( )
| A. | 用过量的O2除去CO2中的CO | B. | 用过量的HC1溶液除去Cu中CuO | ||
| C. | 用过量的NaOH除去CaCl2溶液中HCl | D. | 用过量的FeSO4,除去Zn中Fe |
18.下列化学实验操作正确的是( )
| A. |  滴加液体 | B. |  验满氧气 | C. |  读取液体体积 | D. |  稀释浓硫酸 |
15.根据所学的科学知识,判断下列做法正确的是( )
| A. | 实验室制气体时,先装药品再检查装置气密性 | |
| B. | 深夜醒来闻到浓烈煤气味时,应立即开灯检查家中煤气开关是否关闭 | |
| C. | 水和无机盐在导管内自下而上运输主要是因为蒸腾作用产生的拉力作用 | |
| D. | 高层住宅起火时应先用毛巾蒙鼻,再匍匐前进快速寻找电梯撤离,不可盲目跳楼 |
16.某溶液中含有Ba2+、Ag+、Cu2+三种离子,现用①NaOH溶液、②K2SO4溶液、③盐酸将这三种离子逐一沉淀并加以分离,则加入试剂顺序正确的是( )
| A. | ①②③ | B. | ③②① | C. | ②③① | D. | ②①③ |