题目内容
17.如图1、2是两种元素在周期表中的信息.请回答:(1)铝的相对原子质量是26.98,写出铝原子的结构示意图
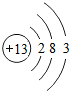 ,其中决定铝元素化学性质的电子层上有m3个电子,铝离子的符号是Al3+.
,其中决定铝元素化学性质的电子层上有m3个电子,铝离子的符号是Al3+.(2)氧原子的原子核内有8个不带电的粒子,则图中的m=16,若氧离子的结构示意图为图3,则Y=8,氧离子的符号是O2-.
(3)写出铝与氧气发生化合反应的化学方程式3Al+2O2$\frac{\underline{\;点燃\;}}{\;}$2Al2O3.
(4)下列6种微粒的结构示意图4中表示阴离子的是B(填序号);

分析 (1)根据元素周期表的信息、原子结构示意图的画法、离子符号的写法来分析;
(2)根据相对原子质量=质子数+中子数以及氧离子的结构来分析;
(3)根据化学方程式的写法来分析;
(4)根据原子中质子数等于核外电子数,阴离子的核外电子数大于核内质子数,阳离子的核内质子数大于核外电子数分析解答.
解答 解:(1)由元素周期表的信息可知,铝元素的相对原子质量为26.98;铝原子的核内有13个质子,核外电子排布为2、8、3结构,原子结构示意图为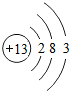 ;决定铝元素化学性质的电子层上有3个电子,在化学反应中易失去3个电子而形成带三个单位正电荷的铝离子;故填:26.98;
;决定铝元素化学性质的电子层上有3个电子,在化学反应中易失去3个电子而形成带三个单位正电荷的铝离子;故填:26.98;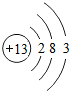 ;3;Al3+;
;3;Al3+;
(2)相对原子质量=质子数+中子数,氧的原子序数为8,质子数为8,核内有8个中子,所以相对原子质量为:8+8=16;氧原子的最外层有6个电子,在化学反应中易得到2个电子而形成最外层为8个电子的结构--氧离子;故填:16;8;O2-;
(3)铝与氧气在点燃的条件下反应生成氧化铝,故填:3Al+2O2$\frac{\underline{\;点燃\;}}{\;}$2Al2O3;
(4)B中质子数小于电子数,所以表示阴离子;故填:B.
点评 本题难度不大,考查学生对粒子结构示意图及其意义的理解,了解粒子结构示意图的意义是正确解题的关键.金属元素在发生化学变化时,易失去最外层的电子,变成阳离子.而非金属元素的原子在发生化学变化时,易得到电子,变成阴离子.

练习册系列答案
相关题目
13.2016年5月,“感知环境,智慧环保”无锡环境监控物联网应用示范工程进入整体试运行阶段,下列做法不利于环境质量提升的是( )
| A. | 对污染水体作处理使之符合排放标准 | |
| B. | 减少使用农家肥,大量使用化肥和农药 | |
| C. | 加大汽车尾气检测力度,减少空气污染 | |
| D. | 应用新技术、新工艺减少污染物的产生 |
5.下列知识的整理完全正确的是( )
| A.实验方法 | B.化学与生活 |
| ①鉴别N2、CO2--用燃着的木条 ②熄灭酒精灯--用嘴吹灭 ③除去铁锈--用稀盐酸 | ①世卫组织推广使用中国铁锅预防贫血症 ②地壳中含量最多的非金属元素是氧元素 ③进入久未开启的菜窖之前做灯火试验 |
| C.实验记录 | D.物质构成 |
| ①用10mL烧杯量取4.8mL水 ②20mL水与20mL酒精混合体积小于40mL ③用托盘天平称取5.6g食盐 | ①空气、液氧、二氧化碳中都含氧分子 ②原子都是由质子、中子和电子构成的 ③铁、铜、汞等金属由原子构成 |
| A. | A | B. | B | C. | C | D. | D |
2.某元素的原子有三个电子层,已知第三层电子数等于第二层与第一层电子数之差,则该元素是( )
| A. | 铝 | B. | 镁 | C. | 硫 | D. | 磷 |
9.咱们学校化学兴趣小组的同学,对实验室制备氧气的若干问题进行如下探究:
(一)为探究影响双氧水分解速度的某种因素,A小组记录了如下实验数据:
(1)本实验中,测量O2体积的装置是c(选填下图1中的装置编号).
(2)实验结论:在相同条件下,过氧化氢浓度越高,双氧水分解速率越快.
(3)B小组用如图2装置进行实验,该变化的文字或符号表达式为过氧化氢$\stackrel{二氧化锰}{→}$水+氧气或2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,通过单位时间内电子天平的质量示数减少的多少比较也能达到实验目的.
(二)C小组查阅资料:在过氧化氢溶液的分解反应中,氧化铜也能作催化剂.于是他们用天平称量0.2g氧化铜,取5mL5%过氧化氢溶液于试管中,进行如下实验:

(1)填写下表:
(2)步骤①的目的是与步骤③对比,检验加入氧化铜前后过氧化氢溶液的分解速率有无变化.
(3)步骤⑦是证明氧化铜的化学性质在反应前后没有改变.
(三)D小组为探究催化剂的种类对氯酸钾分解速度的影响,设计了以下对比实验:
a.将12.25g KClO3与5.0g MnO2均匀混合加热
b.将12.25g KClO3与5.0g CuO均匀混合加热
(1)在相同温度下,比较两组实验产生O2的快慢.通常采用的方法有:
①测相同时间内产生O2的体积;②测收集相同体积O2所需的时间.
(2)计算:12.25g KClO3中所含氧元素质量与克过氧化氢中所含氧元素的质量相等?
(一)为探究影响双氧水分解速度的某种因素,A小组记录了如下实验数据:
| 双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2的体积 | |
| I | 50.0g | 1% | 0.1g | 9mL |
| II | 50.0g | 2% | 0.1g | 16mL |
| III | 50.0g | 4% | 0.1g | 31mL |

(2)实验结论:在相同条件下,过氧化氢浓度越高,双氧水分解速率越快.
(3)B小组用如图2装置进行实验,该变化的文字或符号表达式为过氧化氢$\stackrel{二氧化锰}{→}$水+氧气或2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,通过单位时间内电子天平的质量示数减少的多少比较也能达到实验目的.
(二)C小组查阅资料:在过氧化氢溶液的分解反应中,氧化铜也能作催化剂.于是他们用天平称量0.2g氧化铜,取5mL5%过氧化氢溶液于试管中,进行如下实验:

(1)填写下表:
| 步骤③现象 | 步骤⑥结果 | 步骤⑦操作 | 结论 |
| 有大量气泡产生,带火星的木条复燃; | 固体质量仍为0.2g; | 将固体加入盛有5mL5%过氧化氢溶液的试管中,并把带火星的木条伸入试管,观察现象. | 在过氧化氢溶液的分解反应中,氧化铜也能作催化剂. |
(3)步骤⑦是证明氧化铜的化学性质在反应前后没有改变.
(三)D小组为探究催化剂的种类对氯酸钾分解速度的影响,设计了以下对比实验:
a.将12.25g KClO3与5.0g MnO2均匀混合加热
b.将12.25g KClO3与5.0g CuO均匀混合加热
(1)在相同温度下,比较两组实验产生O2的快慢.通常采用的方法有:
①测相同时间内产生O2的体积;②测收集相同体积O2所需的时间.
(2)计算:12.25g KClO3中所含氧元素质量与克过氧化氢中所含氧元素的质量相等?
