题目内容
2.某元素的原子有三个电子层,已知第三层电子数等于第二层与第一层电子数之差,则该元素是( )| A. | 铝 | B. | 镁 | C. | 硫 | D. | 磷 |
分析 根据元素原子核外有三个电子层,第三层电子数等于第二层与第一层电子数之差,可知前两层已经排满来判定.
解答 解:该原子有三个电子层,说明第一层和第二层已经排满电子,即第一层2个,第二层8个,第二层与第一层电子数之差为6,已知第三层电子数等于第二层与第一层电子数之差,则第三层上有6个电子,即原子核外的电子数为2+8+6=16,核内有16个质子,即硫元素.
故选C.
点评 通过回答本题知道核外电子的排布情况,第一层排满了是2个,第二层排满了是8个电子,排满了第一层才能排第二层,排满了第二层才能排第三层.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
18.下列各组物质按单质、氧化物、混合物顺序排列( )
| A. | 氮气、氯酸钾、海水 | B. | 稀有气体、二氧化碳、空气 | ||
| C. | 氧气、过氧化氢、澄清石灰水 | D. | 红磷、水银、自来水 |
13. 下列结构示意图中,化学性质相似的一组是( )
下列结构示意图中,化学性质相似的一组是( )
 下列结构示意图中,化学性质相似的一组是( )
下列结构示意图中,化学性质相似的一组是( )| A. | ②和④ | B. | ①和④ | C. | ②和③ | D. | ①和③ |
10.某化学兴趣小组在化学实验室发现一瓶没有标签的淡黄色粉末,同学们对探究该粉末产生浓厚兴趣,并在老师的指导下进行探究活动.
【提出问题】这种淡黄色粉末是什么?有什么性质和用途?
【查阅资料】①硫是一种、淡黄色粉末,不溶于水且不与水反应;
②过氧化钠(Na2O2)是淡黄色粉末,在常温下能与水反应生成极易容于水的氢氧化钠和一种无色无味的气体;
③过氧化钠在常温下能与二氧化碳反应生成碳酸钠和氧气,其符号表达式为:CO2+Na2O2→Na2CO3+O2.过氧化钠在呼吸面具中和潜水艇里常用作供氧剂.
【猜想与探究】
①猜想:淡黄色粉末可能是:a.硫;b.过氧化钠;c.硫和过氧化钠的混合物.
②猜想:过氧化钠与水反应生成的气体可能是:a.O2;b.H2.作出这样猜想的依据是反应物中有H、O 或化学反应前后元素种类保持不变.
【交流与讨论】
1.与我们学过的制氧气方法相比,常选用过氧化钠作为呼吸面具和潜水艇的供氧剂的主要理由是:消耗二氧化碳,产生氧气.
2.下列关于Na2O2说法不正确的是ac(填字母序号).
a.Na2O2中氧元素的化合价是-2价
b.Na2O2必须密封保存
c.Na2O2可以用来除去二氧化碳中的水蒸气.
【提出问题】这种淡黄色粉末是什么?有什么性质和用途?
【查阅资料】①硫是一种、淡黄色粉末,不溶于水且不与水反应;
②过氧化钠(Na2O2)是淡黄色粉末,在常温下能与水反应生成极易容于水的氢氧化钠和一种无色无味的气体;
③过氧化钠在常温下能与二氧化碳反应生成碳酸钠和氧气,其符号表达式为:CO2+Na2O2→Na2CO3+O2.过氧化钠在呼吸面具中和潜水艇里常用作供氧剂.
【猜想与探究】
①猜想:淡黄色粉末可能是:a.硫;b.过氧化钠;c.硫和过氧化钠的混合物.
| 探究 | 实验操作 | 实验现象 | 实验结论 |
| ①在一支洁净的试管中加入适量的上述淡黄色粉末,再加入足量的蒸馏水 | 有气泡冒出,固体全部消失 | 猜想b成立. (填字母序号) |
| 继续探究 | 实验操作 | 实验现象 | 实验结论 |
| ②在试管中加入适量的该淡黄色粉末和蒸馏水,将带火星的木条(或燃着的木条)放在试管口部. | 木条复燃 | 生成的气体是 O2 |
1.与我们学过的制氧气方法相比,常选用过氧化钠作为呼吸面具和潜水艇的供氧剂的主要理由是:消耗二氧化碳,产生氧气.
2.下列关于Na2O2说法不正确的是ac(填字母序号).
a.Na2O2中氧元素的化合价是-2价
b.Na2O2必须密封保存
c.Na2O2可以用来除去二氧化碳中的水蒸气.
7.下列有关质量守恒定律的认识,正确的是( )
| A. | 通过化学变化,既能改变物质的种类,也能改变参加反应的物质的总质量 | |
| B. | 质量守恒定律揭示了化学变化中宏观物质之间的质量关系,与微观过程无关 | |
| C. | 蜡烛燃烧后质量减小,说明质量守恒定律不是普遍规律 | |
| D. | 任何化学变化都遵守质量守恒定律 |
11.下列对物质在氧气中燃烧的现象和所属反应类型描述正确的是(
| A. | 铁--黄色火焰--化合反应 | B. | 红磷--蓝色火焰--化合反应 | ||
| C. | 碳--明亮白光--化合反应 | D. | 蜡烛--黄色火焰--分解反应 |
12. 黄金是一种贵重金属,有关金元素说法正确的是( )
黄金是一种贵重金属,有关金元素说法正确的是( )
 黄金是一种贵重金属,有关金元素说法正确的是( )
黄金是一种贵重金属,有关金元素说法正确的是( )| A. | 原子序数为118 | B. | 相对原子质量为197.0 | ||
| C. | 核电荷数为276 | D. | 中子数为79 |
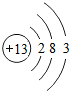 ,其中决定铝元素化学性质的电子层上有m3个电子,铝离子的符号是Al3+.
,其中决定铝元素化学性质的电子层上有m3个电子,铝离子的符号是Al3+.

