题目内容
9.咱们学校化学兴趣小组的同学,对实验室制备氧气的若干问题进行如下探究:(一)为探究影响双氧水分解速度的某种因素,A小组记录了如下实验数据:
| 双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2的体积 | |
| I | 50.0g | 1% | 0.1g | 9mL |
| II | 50.0g | 2% | 0.1g | 16mL |
| III | 50.0g | 4% | 0.1g | 31mL |

(2)实验结论:在相同条件下,过氧化氢浓度越高,双氧水分解速率越快.
(3)B小组用如图2装置进行实验,该变化的文字或符号表达式为过氧化氢$\stackrel{二氧化锰}{→}$水+氧气或2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑,通过单位时间内电子天平的质量示数减少的多少比较也能达到实验目的.
(二)C小组查阅资料:在过氧化氢溶液的分解反应中,氧化铜也能作催化剂.于是他们用天平称量0.2g氧化铜,取5mL5%过氧化氢溶液于试管中,进行如下实验:

(1)填写下表:
| 步骤③现象 | 步骤⑥结果 | 步骤⑦操作 | 结论 |
| 有大量气泡产生,带火星的木条复燃; | 固体质量仍为0.2g; | 将固体加入盛有5mL5%过氧化氢溶液的试管中,并把带火星的木条伸入试管,观察现象. | 在过氧化氢溶液的分解反应中,氧化铜也能作催化剂. |
(3)步骤⑦是证明氧化铜的化学性质在反应前后没有改变.
(三)D小组为探究催化剂的种类对氯酸钾分解速度的影响,设计了以下对比实验:
a.将12.25g KClO3与5.0g MnO2均匀混合加热
b.将12.25g KClO3与5.0g CuO均匀混合加热
(1)在相同温度下,比较两组实验产生O2的快慢.通常采用的方法有:
①测相同时间内产生O2的体积;②测收集相同体积O2所需的时间.
(2)计算:12.25g KClO3中所含氧元素质量与克过氧化氢中所含氧元素的质量相等?
分析 (一)(1)根据气体短管进长管出才能排出试剂瓶中的水、表中实验数据和生成氧气所以敞口的容器中剩余物质的质量减轻分析.
(2)实验结论:根据题干中表格中所给的数据进行分析并完成解答;
(3)根据比较相同时间天平读数差值大小(或电子称上示数减小的速度)也能达到实验目的以及过氧化氢分解生成水和氧气进行解答;
(二)(1)根据氧化铜对过氧化氢的分解有催化作用回答③现象;根据催化剂的定义和特点回答⑥结果.
(2)根据对比实验的探究方法回答.
(3)根据催化剂的作用和特点进行分析回答;
(三)(1)根据在相同温度下,比较两组实验产生O2的快慢可采用测相同时间内产生O2的体积或收集相同体积O2所需的时间进行解答;
(2)根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答
解答 解:(1)图1装置中的c装置中,氧气通过左边导管进入瓶中,由于氧气不易溶于水,把水压入量筒中,量筒中收集的水的体积即为反应生成氧气的体积,因此本实验中,应选用图1装置中的c来测量氧气的体积.
故填:c.
(2)分析该实验数据可得:在双氧水和二氧化锰的质量相同的情况下,双氧水浓度越高,相同时间内产生氧气的体积越多,即在相同条件下,双氧水浓度越高,分解得越快.
故填:过氧化氢浓度越高.
(3)双氧水在二氧化锰的催化作用下生成水和氧气,反应的文字表达式过氧化氢$\stackrel{二氧化锰}{→}$水+氧气,反应的化学方程式为:2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;乙同学用图2装置也可进行甲同学的实验,他通过比较单位时间内电子天平的质量示数减少的多少来确定双氧水分解的快慢,即单位时间内电子天平的质量示数减少的越快,氧气产生的越多,双氧水分解的越快;故填:过氧化氢$\stackrel{二氧化锰}{→}$水+氧气或2H2O2$\frac{\underline{\;MnO_2\;}}{\;}$2H2O+O2↑;单位时间内电子天平的质量示数减少的多少;
(二)(1)氧化铜对过氧化氢的分解有催化作用,能加快其分解速率生成氧气的速率,故步骤③中的现象是有气泡产生,带火星的木条复燃;催化剂的特点是“一变,二不变”,反应前后其质量不变,所以步骤⑥中称量的氧化铜的质量仍为0.2g;故填:有大量气泡产生; 固体质量仍为0.2g;
(2)为了看氧化铜是否能改变反应的速率,要通过加入氧化铜与不加氧化铜的现象进行对比,才能得出科学合理的结论;故填:与步骤③对比,检验加入氧化铜前后过氧化氢溶液的分解速率有无变化;
(3)步骤⑦证明氧化铜的性质在反应前后没有发生改变,在实验中起到的是催化剂的作用;故填:氧化铜的化学性质在反应前后没有改变;
(三):(1)在相同温度下,比较两组实验产生O2的快慢可采用测相同时间内产生O2的体积或收集相同体积O2所需的时间;故答案为:收集相同体积O2所需的时间;
(2)设所需过氧化氢的质量为x,则x×$\frac{32}{34}$×100%=12.25g×$\frac{48}{122.5}$×100%,x=5.1g.故填:5.1.
点评 此题是一道实验探究题,其实验的设计思路是进行对比实验,解题时只要通过实验现象的分析结合对比实验的结论就能对问题进行正确的解答.

 阅读快车系列答案
阅读快车系列答案| A. | 红磷在空气中燃烧,产生大量白色烟雾,放出热量 | |
| B. | 铁丝在空气中剧烈燃烧,火星四溅,放出热量,生成黑色粉末 | |
| C. | 木炭在氧气中燃烧,发出白光,放出热量 | |
| D. | 硫在氧气中燃烧,发出微弱的淡蓝色火焰,放出热量,产生有刺激性气味的气体 |
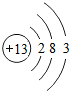 ,其中决定铝元素化学性质的电子层上有m3个电子,铝离子的符号是Al3+.
,其中决定铝元素化学性质的电子层上有m3个电子,铝离子的符号是Al3+.


 某校研究性学习小组对福州某段内河水质的状况进行相关的调查研究.
某校研究性学习小组对福州某段内河水质的状况进行相关的调查研究.