题目内容
1.如图实验操作不正确的是( )| A. |  铁丝在氧气中燃烧 | B. |  读取液体的体积 | ||
| C. |  测溶液的PH | D. |  制取蒸馏水 |
分析 A、根据铁丝在氧气中燃烧的实验注意事项,进行分析判断.
B、根据量筒读数时视线要与凹液面的最低处保持水平进行分析判断.
C、根据用pH试纸测定未知溶液的pH的方法进行分析判断.
D、根据蒸馏操作的注意事项,进行分析判断.
解答 解:A、铁丝在O2中燃烧时,为防止生成物熔化溅落下来使瓶底炸裂,集气瓶的底部应放少量的水或铺一层细沙,图中所示装置正确.
B、量筒读数时视线要与量筒内液体的凹液面的最低处保持水平,图中所示操作正确.
C、用pH试纸测定未知溶液的pH时,正确的操作方法为用玻璃棒蘸取少量待测液滴在干燥的pH试纸上,与标准比色卡对比来确定pH.不能将pH试纸伸入待测液中,以免污染待测液,图中所示操作错误.
D、制取蒸馏水时,为增强冷凝效果,下端管口是进水管,上端管口是出水管,图中所示装置正确.
故选:C.
点评 本题难度不大,熟悉各种仪器的用途及使用注意事项、常见化学实验基本操作的注意事项是解答此类试题的关键.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案 本土教辅赢在暑假高效假期总复习云南科技出版社系列答案
本土教辅赢在暑假高效假期总复习云南科技出版社系列答案 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案
相关题目
6.研究性学习小组中的小张同学在学习中发现:通常检验CO2用饱和石灰水,吸收CO2用浓NaOH溶液.
【实验探究】在体积相同盛满CO2的两集气瓶中,分别加入等体积的饱和石灰水和浓NaOH溶液,实验装置和现象如图所示.请你一起参与.
【现象结论】甲装置中产生的实验现象(用化学方程式表示)Ca(OH)2+CO2═CaCO3↓+H2O.解释通常用石灰水而不用NaOH溶液检验CO2的原因二氧化碳和氢氧化钙反应生成碳酸钙沉淀,和氢氧化钠反应无明显现象;乙装置中的实验现象是气球膨胀,吸收CO2较多的装置是乙.
【拓展延伸】做中和反应实验时,我将稀盐酸滴入氢氧化钠溶液中,意外看到有气泡产生.小张梯形:是不是拿错了药品?我查验后确认药品没错,知识在瓶口发现有白色粉末状物质.我认为是氢氧化钠溶液变质了.
(1)氢氧化钠溶液变质的原因是(用方程式表示)2NaOH+CO2═Na2CO3+H2O.
(2)利用与上述实验不同的原理,我又设计了一个实验再次确认该氢氧化钠溶液已变质.
(3)该氢氧化钠溶液是部分变质还是全部变质?

【实验探究】在体积相同盛满CO2的两集气瓶中,分别加入等体积的饱和石灰水和浓NaOH溶液,实验装置和现象如图所示.请你一起参与.
【现象结论】甲装置中产生的实验现象(用化学方程式表示)Ca(OH)2+CO2═CaCO3↓+H2O.解释通常用石灰水而不用NaOH溶液检验CO2的原因二氧化碳和氢氧化钙反应生成碳酸钙沉淀,和氢氧化钠反应无明显现象;乙装置中的实验现象是气球膨胀,吸收CO2较多的装置是乙.
【拓展延伸】做中和反应实验时,我将稀盐酸滴入氢氧化钠溶液中,意外看到有气泡产生.小张梯形:是不是拿错了药品?我查验后确认药品没错,知识在瓶口发现有白色粉末状物质.我认为是氢氧化钠溶液变质了.
(1)氢氧化钠溶液变质的原因是(用方程式表示)2NaOH+CO2═Na2CO3+H2O.
(2)利用与上述实验不同的原理,我又设计了一个实验再次确认该氢氧化钠溶液已变质.
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量氢氧化钠溶液于试管中,滴加氯化钙溶液 | 产生白色沉淀 | 该氢氧化钠溶液已变质 |
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量氢氧化钠溶液,滴加 足量氯化钙溶液,过滤,向上层清液中滴加 酚酞试液,观察现象 | 产生白色沉淀 酚酞试液变红色(或酚酞试液不变色) | 该氢氧化钠溶液 部分(或全部)变质 |
13.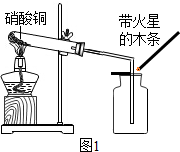 硝酸铜为蓝色固体,溶于水可得蓝色溶液.某实验小组同学用图1装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.
硝酸铜为蓝色固体,溶于水可得蓝色溶液.某实验小组同学用图1装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.
【提出问题】硝酸铜在加热条件下到底发生了怎样的反应?
【查阅资料】
①氧化铜和稀硫酸反应的化学方程式:CuO+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2O
②含氮化合物中,只有NO2是红棕色、有刺激性气味的气体.
③NO2有助燃性,能使带火星的木条复燃
【猜想假设】
Cu(NO3)2受热分解除了生成CuO和O2,还可能生成了NO2
【进行实验】
步骤Ⅱ是同学们查阅了新的资料后设计完成的.该资料是关于NO2沸点(或低温下NO2能否反应生成液态或固态物质)方面的性质信息.
【获得结论】根据实验结果,Cu(NO3)2受热分解的化学方程式为2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑.
【反思与评价】
已知相同状况下,气体的体积比等于其分子个数比.据此,同学们认为,即使没有资料③,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出NO2可能具有助燃性.理由是硝酸铜分解生成的气体中NO2与O2的体积比为4:1,O2所占的体积分数与空气中O2的体积分数相同,分解生成气体能使带火星木条复燃而空气不能,说明NO2有助燃性.
 硝酸铜为蓝色固体,溶于水可得蓝色溶液.某实验小组同学用图1装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.
硝酸铜为蓝色固体,溶于水可得蓝色溶液.某实验小组同学用图1装置加热硝酸铜,发现固体由蓝色逐渐变黑,同时产生红棕色有刺激性气味的气体,带火星的木条复燃.【提出问题】硝酸铜在加热条件下到底发生了怎样的反应?
【查阅资料】
①氧化铜和稀硫酸反应的化学方程式:CuO+H2SO4$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+H2O
②含氮化合物中,只有NO2是红棕色、有刺激性气味的气体.
③NO2有助燃性,能使带火星的木条复燃
【猜想假设】
Cu(NO3)2受热分解除了生成CuO和O2,还可能生成了NO2
【进行实验】
| 实验操作 | 实验现象 | 实验结论 |
| 步骤Ⅰ:将反应后试管中的固体加水充分溶解,过滤,洗涤, 向滤渣中加入足量稀硫酸,加热 | 固体全部溶解,得到蓝色溶液 | 硝酸铜分解生成了氧化铜. |
步骤Ⅱ:在图1的试管和集气瓶之间连图2所示的装置,重新进行加热硝酸铜的实验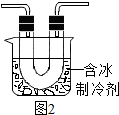 | 集气瓶中气体为无色,带火星木条复燃 | 硝酸铜分解生成了氧气 |
【获得结论】根据实验结果,Cu(NO3)2受热分解的化学方程式为2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+4NO2↑+O2↑.
【反思与评价】
已知相同状况下,气体的体积比等于其分子个数比.据此,同学们认为,即使没有资料③,依据实验结论和“加热硝酸铜产生的气体能使带火星的木条复燃”的实验现象,也能推出NO2可能具有助燃性.理由是硝酸铜分解生成的气体中NO2与O2的体积比为4:1,O2所占的体积分数与空气中O2的体积分数相同,分解生成气体能使带火星木条复燃而空气不能,说明NO2有助燃性.
10.以下是根据一些实验事实推理出的影响化学反应的因素,其中推理错误的是( )
| 序号 | 实验事实 | 影响化学反应的因素 |
| A | 铁丝在空气中很难燃烧,而在氧气中能剧烈燃烧 | 反应物浓度 |
| B | 碳在常温下不与氧气反应,而在点燃时能与氧气反应 | 反应温度 |
| C | 大块木头不易点燃,而刨成非常薄的片状却易点燃 | 反应物的种类 |
| D | 双氧水在常温下缓慢分解,而在加入二氧化锰后迅速分解 | 有、无催化剂 |
| A. | A | B. | B | C. | C | D. | D |
 如图是某同学用来除去水中难溶性杂质时所采用的过滤装置图.试回答:
如图是某同学用来除去水中难溶性杂质时所采用的过滤装置图.试回答:
 甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题;
甲、乙、丙三种固体物质的溶解度曲线如图所示,回答下列问题;