题目内容
17.NaCl和KNO3在不同温度时的溶解度如表,试回答下列问题:| 温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
| 溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
| KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
(2)由海水中获取食盐通常采用“海水晒盐”方式获取食盐,由表中数据分析其原因是氯化钠的溶解度受温度影响变化不大;
(3)KNO3和NaCl在某一温度时具有相同的溶解度x,则x的取值范围是20-30℃;
(4)10℃时,分别将35gNaCl和KNO3固体加入100g水中,升温到60℃时,NaCl溶液为不饱和(填“饱和”或“不饱和”)溶液,升温前后有关溶液说法正确的是BC(填序号)
A.10℃时,两溶液中溶质质量分数相同
B.60℃时,两溶液中溶质质量分数相同
C.升温前后,NaCl溶液中溶质质量分数不变
D.升温前后,KNO3溶液中溶质质量分数不变.
分析 根据固体的溶解度曲线可以:①查出某物质在一定温度下的溶解度,从而确定物质的溶解性,②比较不同物质在同一温度下的溶解度大小,从而判断饱和溶液中溶质的质量分数的大小,③判断物质的溶解度随温度变化的变化情况,从而判断通过降温结晶还是蒸发结晶的方法达到提纯物质的目的.
解答 解:(1)由溶解度表知,20℃时KNO3的溶解度为31.6g,故在50g水中溶解15.8ggKNO3时,溶液恰好达到饱和状态;
(2)由表中数据知,氯化钠的溶解度受温度影响变化不大,所以通常采用“海水晒盐”方式获取食盐;
(3)通过分析溶解度表中的数据可知温度t的范围可能是20-30℃;
(4)由表中数据知,60℃时NaCl的溶解度为37.3g,故35gNaCl加入100g水中,溶液为不饱和溶液;
A、由表中数据知,10℃时两种溶液的溶解度不同,分别将35gNaCl和KNO3固体加入100g水中,氯化钠全部溶解,溶液为不饱和溶液,硝酸钾不能全部溶解,故选项错误;
B、60℃时,两种物质的溶解度都大于35g,将35gNaCl和KNO3固体加入100g水中,溶质全部溶解,故两溶液中溶质质量分数相同,正确;
C、10℃和60℃时氯化钠的溶解度都大于35g,升温前后溶质均全部溶解,质量分数不变,故选项正确;
D、10℃硝酸钾的溶解度小于35g,溶质不能全部溶解,60℃时硝酸钾的溶解度都大于35g,溶质全部溶解,故说法错误.
故答案为:(1)15.8;(2)氯化钠的溶解度受温度影响变化不大;(3)20-30℃;(4)不饱和、BC.
点评 本题难度不是很大,主要考查了固体的溶解度曲线所表示的意义,及根据固体的溶解度曲线来解决相关的问题,从而培养分析问题、解决问题的能力.

练习册系列答案
相关题目
7.下列有关氧气的叙述正确的是( )
| A. | 铁在氧气中燃烧会生成氧化铁固体 | |
| B. | 氧气能和大多数金属、有机物反应,所以氧气是一种很不稳定的气体 | |
| C. | 给氯酸钾加热,若不加二氧化锰就不产生氧气 | |
| D. | 课本上测定空气中氧气含量的实验中,若将红磷换成木炭实验会失败 |
5. 水是生命的源泉,也是不可缺少的资源.
水是生命的源泉,也是不可缺少的资源.
①某矿泉水的主要矿物质成分及含量如下表:
这里Ca、K、Zn、F是指元素 (填“元素、原子、单质”).
②家用净水机中用活性炭的作用是吸附.
③能确认水是由氧元素和氢元素组成的实验是Ⅰ,Ⅲ(填字母).
Ⅰ.氢气在氧气中燃烧生成水Ⅱ.水的蒸发Ⅲ.水的电解Ⅳ.水的净化
④如图所示是a、b、c三种物质的溶解度曲线,根据图示回答:
Ⅰ.P点的含义是t1℃a和c的溶解度相等,都为20g/100g水.
Ⅱ.t2℃时,将30g a物质加入到50g水中不断搅拌,溶液质量为75g.
Ⅲ.要把t1℃时C物质的不饱和溶液变为饱和溶液,有关说法正确的是AD.
A.可以采取升高温度的方法 B.溶剂的质量一定不变
C.溶质的质量分数一定变大 D.溶质的质量可能不变
Ⅳ.若a溶液中含有少量b,则提纯a的方法是蒸发浓缩、降温结晶.
Ⅴ.将t3℃时将等质量的a、b、c三种物质饱和溶液降温到t1℃时,三种溶液的溶剂质量大小关系是a<b<c.
 水是生命的源泉,也是不可缺少的资源.
水是生命的源泉,也是不可缺少的资源.①某矿泉水的主要矿物质成分及含量如下表:
| 成分 | Ca | K | Zn | F |
| 含量(mg/L) | 20 | 3 | 0.06 | 0.02 |
②家用净水机中用活性炭的作用是吸附.
③能确认水是由氧元素和氢元素组成的实验是Ⅰ,Ⅲ(填字母).
Ⅰ.氢气在氧气中燃烧生成水Ⅱ.水的蒸发Ⅲ.水的电解Ⅳ.水的净化
④如图所示是a、b、c三种物质的溶解度曲线,根据图示回答:
Ⅰ.P点的含义是t1℃a和c的溶解度相等,都为20g/100g水.
Ⅱ.t2℃时,将30g a物质加入到50g水中不断搅拌,溶液质量为75g.
Ⅲ.要把t1℃时C物质的不饱和溶液变为饱和溶液,有关说法正确的是AD.
A.可以采取升高温度的方法 B.溶剂的质量一定不变
C.溶质的质量分数一定变大 D.溶质的质量可能不变
Ⅳ.若a溶液中含有少量b,则提纯a的方法是蒸发浓缩、降温结晶.
Ⅴ.将t3℃时将等质量的a、b、c三种物质饱和溶液降温到t1℃时,三种溶液的溶剂质量大小关系是a<b<c.
12. 室温时,向氢氧化钠溶液中逐滴加入稀盐酸,符合右图中纵坐标X的表示是( )
室温时,向氢氧化钠溶液中逐滴加入稀盐酸,符合右图中纵坐标X的表示是( )
 室温时,向氢氧化钠溶液中逐滴加入稀盐酸,符合右图中纵坐标X的表示是( )
室温时,向氢氧化钠溶液中逐滴加入稀盐酸,符合右图中纵坐标X的表示是( )| A. | 溶液的温度 | B. | 溶液中氯化钠的质量 | ||
| C. | 溶液中含有HCl的物质的量 | D. | 溶液中氯化钠的质量分数 |
2.下列有关化学与生活知识的叙述中,不正确的是( )
| A. | 绿色化学的核心是利用化学原理从源头上减少和消除工业生产 | |
| B. | 用氢氧化镁代替氢氧化铝中和过多胃酸 | |
| C. | 人体缺乏维生素A会引起夜盲症 | |
| D. | 日常生活中使用的有机玻璃、睛纶、蚕丝等都属于合成纤维 |
5.潜水艇有两种供氧的装置,第一种是储备压缩氧气,第二种是在紧急的情况下才使用的过氧化钠(Na2O2)做供氧剂,小红同学对过氧化钠如何做供氧剂产生浓厚的兴趣,于是他在老师的指导下展开了以下的探究活动.
[查阅资料]
1、过氧化钠是用在矿山、坑道、潜水或宇宙飞船等缺氧的场合,将人们呼出的CO2转换成O2,以供呼吸之用.
2.二氧化碳与过氧化钠反应的生成物只有两种,一种是氧气,另一种是化合物.
3.人呼出的气体中含有的水分也能与过氧化钠反应生成氧气.
(1)小红利用如图1的BCDE装置组合和有关药品制取并收集氧气.

若用大理石与稀盐酸制取二氧化碳,则B中装置可采用上图中的②(填数字序号,下同);E中装置可采用如图2中的③;B中的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)二氧化碳与过氧化钠反应除生成氧气还生成什么物质?
[作出猜想]二氧化碳与过氧化钠反应生成的化合物到底是什么物质?小红作出了以下三种猜想:
①是碳酸 ②是氢氧化钠 ③是碳酸钠
通过对反应物有关的元素组成的分析,乙同学认为猜想①②(填数字序号)一定是错误的,理由是二氧化碳与过氧化钠都不含氢元素,根据质量守恒定律,不可能生成含有氢元素的碳酸或氢氧化钠.
[进行实验]小红通过以下实验验证了另一个猜想的正确性,请完成下述实验报告.
[反思与交流]
①小红若用图A来代替B装置,证明二氧化碳与过氧化钠反应生成了氧气,你是否同意小红的做法?否(填“是”或“否”)原因:人呼出的气体中的水蒸气也能与过氧化钠反应生成氧气.
②由此可知道过氧化钠与二氧化碳反应的化学方程式为:2Na2O2+2CO2=O2+2Na2CO3.
[查阅资料]
1、过氧化钠是用在矿山、坑道、潜水或宇宙飞船等缺氧的场合,将人们呼出的CO2转换成O2,以供呼吸之用.
2.二氧化碳与过氧化钠反应的生成物只有两种,一种是氧气,另一种是化合物.
3.人呼出的气体中含有的水分也能与过氧化钠反应生成氧气.
(1)小红利用如图1的BCDE装置组合和有关药品制取并收集氧气.

若用大理石与稀盐酸制取二氧化碳,则B中装置可采用上图中的②(填数字序号,下同);E中装置可采用如图2中的③;B中的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.
(2)二氧化碳与过氧化钠反应除生成氧气还生成什么物质?
[作出猜想]二氧化碳与过氧化钠反应生成的化合物到底是什么物质?小红作出了以下三种猜想:
①是碳酸 ②是氢氧化钠 ③是碳酸钠
通过对反应物有关的元素组成的分析,乙同学认为猜想①②(填数字序号)一定是错误的,理由是二氧化碳与过氧化钠都不含氢元素,根据质量守恒定律,不可能生成含有氢元素的碳酸或氢氧化钠.
[进行实验]小红通过以下实验验证了另一个猜想的正确性,请完成下述实验报告.
| 实验步骤 | 实验现象 | 实验结论 |
| 将CO2与Na2O2反应后的固体取少量于试管中,加入稀盐酸(或稀硫酸等),把产生的气体通入足量的澄清石灰水中 | ①有大量气泡产生 ②澄清石灰水变浑浊 | 猜想③是正确的 |
①小红若用图A来代替B装置,证明二氧化碳与过氧化钠反应生成了氧气,你是否同意小红的做法?否(填“是”或“否”)原因:人呼出的气体中的水蒸气也能与过氧化钠反应生成氧气.
②由此可知道过氧化钠与二氧化碳反应的化学方程式为:2Na2O2+2CO2=O2+2Na2CO3.
2.某兴趣小组的利用浓盐酸烧碱实验探究分子的运动,如图1所示:
(1)填写实验报告:
(2)实验讨论:
①该兴趣小组为使实验结论准确可靠,设计实验装置如图乙进行对比实验,你认为有无必要?说明理由.无必要;蒸馏水不能使酚酞变红,在第一个实验中已经可以证明了
②将一定质量的浓盐酸盛于烧杯中,敞口放置在实验室安全之处.浓盐酸的质量和放置天数关系的曲线(如图2)正确的是乙(填写“甲”或“乙”),你的选择理由是浓盐酸具有挥发性,能挥发出溶质氯化氢,使溶液质量变小;
③若上述浓盐酸中溶剂所含氢原子数是溶质所含氢原子数的7倍,则该浓盐酸中溶质的质量分数为多少?(写出计算过程,精确到0.1%).
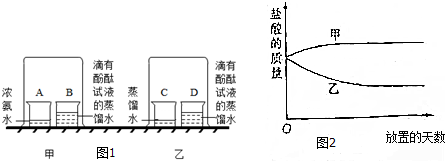
(1)填写实验报告:
| 实验步骤 | 实验现象 | 分析与结论 |
| ①在盛有少量蒸馏水的烧杯中滴入2~3滴石蕊试液 | 液体显紫色 | 结论:蒸馏水不能使酚酞变红 |
| ②在步骤①的烧杯中再滴加浓盐酸 | 试液变红 | 结论:酸性溶液能使紫色石蕊试液变红 |
| ③按图甲所示进行实验 | 烧杯B中试液变红 | 原因:由于浓盐酸具有较强的挥发性,所以倒扣的烧杯中会有大量的氯化氢分子存在,这些氯化氢的分子溶于烧杯B中会使该溶液变为稀盐酸而呈酸性,所以烧杯B中的紫色石蕊会变为红色, 结论:分子是不断运动的 |
①该兴趣小组为使实验结论准确可靠,设计实验装置如图乙进行对比实验,你认为有无必要?说明理由.无必要;蒸馏水不能使酚酞变红,在第一个实验中已经可以证明了
②将一定质量的浓盐酸盛于烧杯中,敞口放置在实验室安全之处.浓盐酸的质量和放置天数关系的曲线(如图2)正确的是乙(填写“甲”或“乙”),你的选择理由是浓盐酸具有挥发性,能挥发出溶质氯化氢,使溶液质量变小;
③若上述浓盐酸中溶剂所含氢原子数是溶质所含氢原子数的7倍,则该浓盐酸中溶质的质量分数为多少?(写出计算过程,精确到0.1%).


