题目内容
9.如图是对20℃一定质量甲的溶液进行恒温蒸发的结晶实验过程,请回答: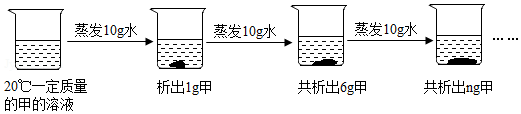
(1)蒸发前原溶液是不饱和(填“饱和”或“不饱和”)溶液,n的数值是11,该温度下,甲溶液的溶解度是50g.
(2)依据上述实验,你认为甲的溶解度随温度变化的趋势是C(填字母)的.
A.随温度升高而增大 B.随温度升高而减小 C.无法判断
(3)第3杯溶液的质量分数为33.3%
(4)溶液中溶质质量分数的比较:第2个烧杯=第3个烧杯(填“>”、“=”或“<”).
分析 (1)根据饱和溶液的定义和判断方法进行分析;
根据题中的数据进行分析;
(2)根据题中析出晶体是通过蒸发溶剂得到的进行分析;
(3)(4)根据饱和溶液溶质质量分数的计算与溶解度有关.
解答 解:(1)蒸发前的烧杯底部没有固体,第一次蒸发10g水,析出1g晶体,第二次蒸发10g水析出5g晶体,所以蒸发前原溶液是不饱和溶液,第三次蒸发10g水析5g晶体,所以共析出11g,通过分析可知蒸发10g水析出5g晶体,所以100g水中最多溶解50g,所以甲物质在该温度下的溶解度是50g;
(2)题中析出晶体是通过蒸发溶剂得到的,不能判断出温度对溶解度的影响,故选:C;
(3)第3杯溶液是饱和溶液,溶质质量分数为:$\frac{50g}{150g}$×100%=33.3%;
(4)第2个烧杯和第3个烧杯中都含有不溶解的固体,说明溶液都达到了饱和状态,饱和溶液的溶质质量分数=$\frac{溶解度}{100g+溶解度}$×100%,温度不变,溶解度不变,所以溶质质量分数相等.
故答案为:(1)不饱和,11,50g;
(2)C;
(3)33.3%;
(4)═.
点评 本题是对物质溶解度、溶液的配制、溶质的质量分数等知识的考查,解决的重点是能理解溶解度、溶质质量分数的概念以及物质溶解度随温度的变化,并能利用相关知识分析并解决问题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
1.现有银、铜、铁三种金属,某研究小组的同学为探究银、铜、铁的金属活动性顺序,设计了三个实验:
Ⅰ.将铁片浸入稀硫酸中;
Ⅱ.将银片浸入稀硫酸中;
Ⅲ.将铁片浸入硫酸铜溶液中.
(1)实验Ⅰ的现象是:有气泡产生,溶液由无色逐渐变为浅绿色.反应的化学方程式为Fe+H2SO4═FeSO4+H2↑;反应产生的气体可用点燃的方法检验.
(2)上述三个实验还不能完全证明三种金属的活动性顺序,请你补充一个实验来达到实验目的(写出实验操作和现象)把铜片伸入硝酸银溶液中,铜片表面附着一层银白色固体
根据以上探究,三种金属的活动性由强到弱的顺序是铁>铜>银.
(3)将银、铁两种金属分别放入硫酸铜等溶液中,即可验证这三种金属的活动性强弱.
(4)将铜片加热,铜片的表面变黑.同学们设计如下实验证明此黑色物质是氧化铜.
Ⅰ.将铁片浸入稀硫酸中;
Ⅱ.将银片浸入稀硫酸中;
Ⅲ.将铁片浸入硫酸铜溶液中.
(1)实验Ⅰ的现象是:有气泡产生,溶液由无色逐渐变为浅绿色.反应的化学方程式为Fe+H2SO4═FeSO4+H2↑;反应产生的气体可用点燃的方法检验.
(2)上述三个实验还不能完全证明三种金属的活动性顺序,请你补充一个实验来达到实验目的(写出实验操作和现象)把铜片伸入硝酸银溶液中,铜片表面附着一层银白色固体
根据以上探究,三种金属的活动性由强到弱的顺序是铁>铜>银.
(3)将银、铁两种金属分别放入硫酸铜等溶液中,即可验证这三种金属的活动性强弱.
(4)将铜片加热,铜片的表面变黑.同学们设计如下实验证明此黑色物质是氧化铜.
| ①实验操作 | ②实验现象 |
| 剪下一片变黑的铜片,放入试管中,加入足量的稀硫酸溶液 | 铜片表面的黑色物质全部消失,露出红色的铜,溶液变为蓝色 |
18.用I2O5可以测定空气受CO污染的程度,发生的反应是 I2O5+5CO$\frac{\underline{\;\;△\;\;}}{\;}$I2+5CO2 根据生成的CO2的多少,可以判断CO的含量.关于这个反应,下列说法错误的是( )
| A. | I2O5发生的是氧化反应,是氧化剂 | |
| B. | 参加反应的各物质中所含的氧原子的总数等于生成的CO2中所含的氧原子总数 | |
| C. | 反应物所含元素种类与生成物所含的元素种类相同 | |
| D. | 参加反应的I2O5和CO的总质量等于生成的I2和CO2的总质量 |
19.下列说法正确的是( )
| A. | 稀释浓硫酸时,将浓硫酸沿量筒壁慢慢注入水中,并用玻璃棒不断搅拌 | |
| B. | 浓硫酸露置于空气中,溶质的质量不变 | |
| C. | 长期露置于空气中的固体氢氧化钠,其成分不会发生变化 | |
| D. | 测溶液pH时,将待测溶液倾倒在pH试纸上,将pH试纸的颜色与标准比色卡比较即可 |

 为了探究石灰石与稀盐酸反应制备二氧化碳后的废液中的溶质成分,将废液过滤,取滤液20g于烧杯中,在不断振荡的条件下,向其中滴加质量分数为10.6%的碳酸钠溶液直至过量,有关的变化如图所示:根据题中有关信息和图象分析回答下列问题
为了探究石灰石与稀盐酸反应制备二氧化碳后的废液中的溶质成分,将废液过滤,取滤液20g于烧杯中,在不断振荡的条件下,向其中滴加质量分数为10.6%的碳酸钠溶液直至过量,有关的变化如图所示:根据题中有关信息和图象分析回答下列问题 有一包固体粉末,可能是碳酸钙、硫酸钠、硫酸铜、碳酸钠中的一种或多种.某实验小组对其成分进行了探究活动.
有一包固体粉末,可能是碳酸钙、硫酸钠、硫酸铜、碳酸钠中的一种或多种.某实验小组对其成分进行了探究活动.