题目内容
17. 有一包固体粉末,可能是碳酸钙、硫酸钠、硫酸铜、碳酸钠中的一种或多种.某实验小组对其成分进行了探究活动.
有一包固体粉末,可能是碳酸钙、硫酸钠、硫酸铜、碳酸钠中的一种或多种.某实验小组对其成分进行了探究活动. 第一步:取一定量的固体粉末.加入足量的水充分搅拌,溶液澄清,无沉淀,得到蓝色溶液.则此固
粉末中一定没有CaCO3;Na2CO3.(写化学式)
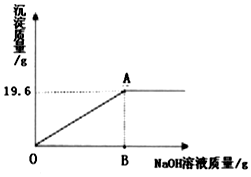
第二步:为进一步确定此固体粉末的组成,实验小组同学用天平称46.2克此固体粉末,完全溶于水中得到245.6克溶液,再向其中加入溶质质量分数为8%的氢氧化钠溶液,产生沉淀的质量与加入氢氧化钠溶液质量的关系如图所示.据图回答:
(1)产生最大沉淀量时加入氢氧化钠溶液的质量为200克.
(2)计算A点所示溶液中溶质的质量分数.
分析 考虑碳酸钙不溶于水;硫酸铜溶液是蓝色的;硫酸铜和氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,根据沉淀的质量可以计算硫酸铜的质量、氢氧化钠的质量和反应生成的硫酸钠的质量,进一步可以计算产生最大沉淀量时所加NaOH溶液的质量和A点所示溶液中溶质的质量分数,同时可以确定46.2g固体粉末的组成.
解答 解:取一定量上述固体粉末,加足量水溶解,得到蓝色澄清溶液,说明固体中不含有碳酸钙和碳酸钠,一定含有硫酸铜,无法确定是否含有硫酸钠.故填:CaCO3;Na2CO3.
(1)设硫酸铜的质量为x,氢氧化钠的质量为y,生成硫酸钠的质量为z.
由图中数据可知,产生最大沉淀量是9.8g.
CuSO4+2NaOH═Cu(OH)2↓+Na2SO4
160 80 98 142
x y 19.6g z
则$\frac{160}{x}=\frac{80}{y}=\frac{98}{19.6g}=\frac{142}{z}$,解得x=32g,y=16g,z=28.4g.
产生最大沉淀量时所加NaOH溶液的质量为:16g÷8%=200g.
答:产生最大沉淀量时所加NaOH溶液的质量为200g.
(2)固体中硫酸钠的质量为:46.2g-32g=14.2g.
故A点所示溶液中溶质的质量分数$\frac{14.2g+14.2g}{245.6g+200g-19.6g}$×100%≈6.67%
故答案为:
CaCO3、Na2CO3 ,200g;6.67%.
点评 本题主要考查物质的性质和根据化学方程式进行计算的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
12.用已知溶质质量分数的溶液可以测定未知溶液的溶质质量分数.实验室有一瓶标签模糊的稀盐酸,某同学为了测定其溶质质量分数,进行了如下实验:
①取一洁净的锥形瓶称量,然后往其中加入一定量的稀盐酸,并滴人几滴紫色石蕊试液(质量忽略不计),重新称量; ②往上述锥形瓶中逐滴加入溶质质量分数为16%的氢氧化钠溶液,边滴加边振荡,当观察到溶液由红色恰好变为紫色时,停止滴加,再次称量.数据如表:
(1)本次实验中,实际消耗的氢氧化钠溶液质量为25克.
(2)请通过计算确定该瓶稀盐酸的溶质质量分数.
①取一洁净的锥形瓶称量,然后往其中加入一定量的稀盐酸,并滴人几滴紫色石蕊试液(质量忽略不计),重新称量; ②往上述锥形瓶中逐滴加入溶质质量分数为16%的氢氧化钠溶液,边滴加边振荡,当观察到溶液由红色恰好变为紫色时,停止滴加,再次称量.数据如表:
| 锥形瓶 | 锥形瓶+稀盐酸 | 锥形瓶+反应后溶液 | |
| 质量(克) | 35.5 | 55.5 | 80.5 |
(2)请通过计算确定该瓶稀盐酸的溶质质量分数.
5.下列曲线图能正确表达相应反应或过程的是( )

| A. | 一个烧杯中盛有稀盐酸和氯化镁溶液,滴加澄清石灰水 | |
| B. | 将 pH=1 的溶液加水稀释 | |
| C. | 向一定质量的 NaOH 溶液中滴入稀盐酸 | |
| D. | 向澄清石灰水中加入一定量的生石灰 |
2.表面部分被氧化的镁条2.6g,与某浓度的50g稀硫酸恰好完全反应,生成0.2g氢气.该稀硫酸的质量分数是( )
| A. | 20.58% | B. | 19.6% | C. | 98% | D. | 22.86% |
6.某化肥厂需大量CO2生产化肥,欲购进一批石灰石(石灰石样品中含有的杂质不溶于水,也不与盐酸反应),厂家到产地取样分析以确定价格,他们取样6克,并把40克稀盐酸分四次加入,充分反应后,每次剩余固体的质量见表.
试回答下列问题:
(1)该化学反应属于基本类型中的复分解反应
(2)加入稀盐酸已过量的实验次序有3、4
(3)所用稀盐酸的溶质质量分数为多少?
(4)石灰石样品中CaCO3的质量分数是多少?
| 加入稀盐酸的次序 | 1 | 2 | 3 | 4 |
| 加入稀盐酸的质量(克) | l0 | 10 | l0 | l0 |
| 剩余固体的质量(克) | 4.0 | 2.0 | 0.6 | 0.6 |
(1)该化学反应属于基本类型中的复分解反应
(2)加入稀盐酸已过量的实验次序有3、4
(3)所用稀盐酸的溶质质量分数为多少?
(4)石灰石样品中CaCO3的质量分数是多少?