题目内容
6.2.2g某有机物在氧气中完全燃烧,生成6.6g二氧化碳和3.6g水(无其它生成物).下列对该物质组成的推断正确的是( )| A. | 只含碳、氢元素 | B. | 含有碳、氢、氧三种元素 | ||
| C. | 含有碳、氢元素,可能含有氧元素 | D. | 碳、氢原子个数比为3:4 |
分析 化学反应遵循质量守恒定律,即化学反应前后,元素的种类不变,原子的种类、总个数不变,这是书写化学方程式、判断物质的化学式、判断化学计量数、进行相关方面计算的基础.
解答 解:根据质量守恒定律可知,参加反应的氧气质量为:6.6g+3.6g-2.2g=8g,
6.6g二氧化碳中碳元素的质量为:6.6g×$\frac{12}{44}$×100%=1.8g,氧元素的质量为:6.6g-1.8g=4.8g; 3.6g水中氢元素的质量为:3.6g×$\frac{2}{18}$×100%=0.4g,氧元素的质量为:3.6g-0.4g=3.2g;
该物质中氧元素的质量为:4.8g+3.2g-8g=0;
由分析可知,该物质由碳元素、氢元素组成;
碳原子和氢原子的个数比为:$\frac{1.8g}{12}$:$\frac{0.4g}{1}$=3:8.
故选:A.
点评 化学反应遵循质量守恒定律,即参加反应的物质的质量之和,等于反应后生成的物质的质量之和.
化学反应前后,元素的种类不变,原子的种类、总个数不变.

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目
16.ClO2是新一代自来水消毒剂,如图为制取ClO2反应的微观示意图.( )

| A. | x是化合物,y单质 | |
| B. | z、w都是氧化物 | |
| C. | 该反应属于置换反应 | |
| D. | 该反应的化学方程式为:2NaClO2+Cl2═2NaCl+ClO2 |
1.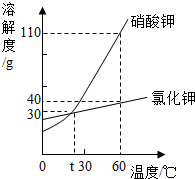 如图是硝酸钾和氣化钾的溶解度曲线,下列说法正确的是( )
如图是硝酸钾和氣化钾的溶解度曲线,下列说法正确的是( )
 如图是硝酸钾和氣化钾的溶解度曲线,下列说法正确的是( )
如图是硝酸钾和氣化钾的溶解度曲线,下列说法正确的是( )| A. | 硝酸钾的溶解度一定大于氯化钾的溶解度 | |
| B. | t℃时,硝酸钾溶液的浓度一定等于氯化钾溶液的浓度 | |
| C. | 把60℃时硝酸钾溶液降温至30℃,一定有硝酸钾晶体析出 | |
| D. | 60℃时,把50 g上述物质分别加入到50 g水中,充分溶解得到硝酸钾溶液的质量一定大于氯化钾溶液的质量 |
18.下列含氮化合物中,氮元素化合价代数和为零的是( )
| A. | (NH4)2SO4 | B. | (NH4)2HPO4 | C. | NH4NO2 | D. | NH4NO3 |
6.小明在做实验时,不小心将镁条掉入到碳酸氢钠溶液中,发现产生大量的气泡和白色不溶物.他非常好奇,进行了如下探究.
【提出问题】镁条与碳酸氢钠溶液反应,产生的气体和白色不溶物分别是什么?
【查阅资料】
实验探究一:镁条与碳酸氢钠溶液反应产生什么气体呢?
实验探究二:
【提出问题】镁条与碳酸氢钠溶液反应,产生的白色不溶物是什么?
【作出猜想】小明根据资料分析认为白色不溶物可能是:
猜想A:Mg(OH)2;猜想B:MgCO3;猜想C:Mg(OH)2和MgCO3;
【进行实验】

(1)定性测定白色不溶物的组成:由实验Ⅰ可推断猜想A不成立,则实验Ⅰ方案为:向白色不溶物样品中滴加稀盐酸,有气体产生,将气体通入澄清石灰水中,变浑浊则证明有碳酸镁存在;
(2)定量测定白色不溶物的组成:
①实验Ⅱ:加入稍过量的稀盐酸,若盐酸浓度为10%,则所用盐酸的质量至少是19.6g(结果保留一位小数);
②称量“干燥的晶体”质量为 2.85g,由此可推断猜想C成立.
【提出问题】镁条与碳酸氢钠溶液反应,产生的气体和白色不溶物分别是什么?
【查阅资料】
| Mg(OH)2 | MgCO3 | |
| 溶解性 | 难溶于水 | 微溶于水 |
| 热稳定性 | 受热易分解,能生成两种氧化物 | 受热易分解,能生成两种氧化物 |
| 猜想 | 实验方法 | 现象 | 结论 | |
| ① | 二氧化碳 | 收集气体于集气瓶中,而后将气体通入澄清石灰水中; | 无明显现象 | 猜想①不成立 |
| ② | 氧气 | 收集气体于集气瓶中,而后将带火星的木条放入瓶中; | 无明显现象 | 猜想②不成立 |
| ③ | 氢气 | 第一步,点燃产生的气体; 第二步,在火焰上罩内壁涂有石灰水 的烧杯. | 气体能被点燃,产生蓝色火焰;烧杯内壁无现象; | 猜想③成立 |
| ④ | ||||
| ⑤ | 甲烷 | |||
【提出问题】镁条与碳酸氢钠溶液反应,产生的白色不溶物是什么?
【作出猜想】小明根据资料分析认为白色不溶物可能是:
猜想A:Mg(OH)2;猜想B:MgCO3;猜想C:Mg(OH)2和MgCO3;
【进行实验】

(1)定性测定白色不溶物的组成:由实验Ⅰ可推断猜想A不成立,则实验Ⅰ方案为:向白色不溶物样品中滴加稀盐酸,有气体产生,将气体通入澄清石灰水中,变浑浊则证明有碳酸镁存在;
(2)定量测定白色不溶物的组成:
①实验Ⅱ:加入稍过量的稀盐酸,若盐酸浓度为10%,则所用盐酸的质量至少是19.6g(结果保留一位小数);
②称量“干燥的晶体”质量为 2.85g,由此可推断猜想C成立.
 实验室利用下图装置测量久置于空气中NaOH样品的纯度.取2g样品与足量稀盐酸反应,产生气体在量程范围内,气体的密度为1.95g/L) 请回答下列问题.
实验室利用下图装置测量久置于空气中NaOH样品的纯度.取2g样品与足量稀盐酸反应,产生气体在量程范围内,气体的密度为1.95g/L) 请回答下列问题. :
: