题目内容
1.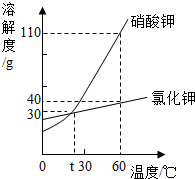 如图是硝酸钾和氣化钾的溶解度曲线,下列说法正确的是( )
如图是硝酸钾和氣化钾的溶解度曲线,下列说法正确的是( )| A. | 硝酸钾的溶解度一定大于氯化钾的溶解度 | |
| B. | t℃时,硝酸钾溶液的浓度一定等于氯化钾溶液的浓度 | |
| C. | 把60℃时硝酸钾溶液降温至30℃,一定有硝酸钾晶体析出 | |
| D. | 60℃时,把50 g上述物质分别加入到50 g水中,充分溶解得到硝酸钾溶液的质量一定大于氯化钾溶液的质量 |
分析 A、比较溶解度大小须确定温度;
B、不知溶液中溶质、溶剂质量多少,无法判断溶质的质量 分数大小;
C、不知溶液是否饱和,无法判断降温是否析出晶体;
D、据该 温度下硝酸钾和氯化钾的溶解度分析解答.
解答 解:A、比较溶解度大小须确定温度,故错误;
B、不知溶液中溶质、溶剂质量多少,无法判断溶质的质量 分数大小,故错误;
C、不知溶液是否饱和,无法判断降温是否析出晶体,若饱和则一定析出硝酸钾晶体,故错误;
D、60℃时硝酸钾和氯化钾的溶解度分别是110g、40g,即100g水中最多溶解溶质的质量分别是110g、40g,所以把50 g上述物质分别加入到50 g水中,硝酸钾可全部溶解,氯化钾最多溶解20g,故充分溶解得到硝酸钾溶液的质量一定大于氯化钾溶液的质量,正确;
故选:D.
点评 明确溶解度概念、溶质质量分数、和结晶的方法等知识,才能结合题意灵活解答,要注意细心分析.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
11.小亮在实验室发现一瓶盛有无色溶液的试剂瓶,其标签破损,从残余部分只能看出溶质的质量分数为10%,具体是什么物质无法辨认.老师告诉他,这瓶溶液可能是氢氧化纳、氯化钠、氢氧化钙或是碳酸钠中的一种.
(1)小亮查阅氢氧化钙常温下的溶解度为0.18g后,认为该溶液不可能是氢氧化钙,理由是Ca(OH)2微溶于水,常温下不可能得到10%的氢氧化钙溶液.
(2)小亮取少量样品于试管中,滴加无色酚酞 试液,试液变红色,该溶液不可能是NaCl(填写化学式),理由是NaCl溶液呈中性,不能使无色酚酞试液变红色.
(3)为了确定该溶液的成分,小亮同学继续进行下列实验,请一起参与,并填写下列实验报告.
【设计实验方案】方案甲:选择氯化钙溶液来确定该溶液的成份;方案乙:选择稀盐酸来确定该溶液的成份.
【进行实验】你愿意选择方案乙(选填“甲”或“乙”)进行实验.
(4)玉鹏同学认为还可以用一种不同于甲、乙类别的物质来确定,请你帮他完成,该物质可以为石灰水.
(1)小亮查阅氢氧化钙常温下的溶解度为0.18g后,认为该溶液不可能是氢氧化钙,理由是Ca(OH)2微溶于水,常温下不可能得到10%的氢氧化钙溶液.
(2)小亮取少量样品于试管中,滴加无色酚酞 试液,试液变红色,该溶液不可能是NaCl(填写化学式),理由是NaCl溶液呈中性,不能使无色酚酞试液变红色.
(3)为了确定该溶液的成分,小亮同学继续进行下列实验,请一起参与,并填写下列实验报告.
【设计实验方案】方案甲:选择氯化钙溶液来确定该溶液的成份;方案乙:选择稀盐酸来确定该溶液的成份.
【进行实验】你愿意选择方案乙(选填“甲”或“乙”)进行实验.
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量溶液于试管中,滴加氯化钙溶液(或稀盐酸). | 产生白色沉淀(或有气泡冒出) | 该溶液是碳酸钠溶液. 有关反应的化学方程式为: CaCl2+Na2CO3=CaCO3↓+2NaCl(或Na2CO3+2HCl=2NaCl+H2O+CO2↑). |
| 实验步骤 | 实验现象 | 实验结论 |
| 取少量溶液于试管中,滴加该物质 | 产生白色沉淀 | 该溶液是碳酸钠溶液.有关反应的化学方程式为:Ca(OH)2+Na2CO3═CaCO3↓+2NaOH |
9.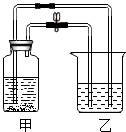 物质由元素组成,请根据H、C、O、Cl、Ca、Na、Fe七种元素回答下列问题.
物质由元素组成,请根据H、C、O、Cl、Ca、Na、Fe七种元素回答下列问题.
(1)某固体可以用于人工降雨,组成该固体的元素为C、O.
(2)A、B两种物质分别由1种或2种元素组成,进行如下实验.
①A物质的化学式为Fe.
②B中滴加稀盐酸,发生反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O.
(3)如图所示,打开止水夹和胶塞,向放有少量固体C的甲中加入足量D的溶液,塞紧胶塞,观察到甲中有气泡,乙中溶液变浑浊.关闭止水夹,甲中无色液体流入乙中,乙中有气泡产生,浑浊液变为无色溶液.乙中溶液变浑浊反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O;甲中无色液体流入乙中时所含溶质可能的组成为HCl、CaCl2或HCl、NaCl.
 物质由元素组成,请根据H、C、O、Cl、Ca、Na、Fe七种元素回答下列问题.
物质由元素组成,请根据H、C、O、Cl、Ca、Na、Fe七种元素回答下列问题.(1)某固体可以用于人工降雨,组成该固体的元素为C、O.
(2)A、B两种物质分别由1种或2种元素组成,进行如下实验.
| 物质 | A | B |
| 滴加的物质 | 稀盐酸 | 稀盐酸 |
| 现象 | 生成浅绿色溶液和一种可燃性气体 | 生成黄色溶液 |
②B中滴加稀盐酸,发生反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O.
(3)如图所示,打开止水夹和胶塞,向放有少量固体C的甲中加入足量D的溶液,塞紧胶塞,观察到甲中有气泡,乙中溶液变浑浊.关闭止水夹,甲中无色液体流入乙中,乙中有气泡产生,浑浊液变为无色溶液.乙中溶液变浑浊反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O;甲中无色液体流入乙中时所含溶质可能的组成为HCl、CaCl2或HCl、NaCl.
6.2.2g某有机物在氧气中完全燃烧,生成6.6g二氧化碳和3.6g水(无其它生成物).下列对该物质组成的推断正确的是( )
| A. | 只含碳、氢元素 | B. | 含有碳、氢、氧三种元素 | ||
| C. | 含有碳、氢元素,可能含有氧元素 | D. | 碳、氢原子个数比为3:4 |
1.在化学课上,甲同学将燃烧的钠迅速伸入带盛有CO2的集气瓶中,钠在其中继续燃烧,反应后冷却,瓶底附着黑色颗粒,瓶壁上粘附着白色物质.
【提出问题】:黑色颗粒和白色物质可能是什么呢?
【进行猜想】甲认为黑色颗粒是C,白色物质可能是Na2O或Na2CO3.
乙同学还认为白色物质是氢氧化钠.甲同学立刻认为乙同学的猜想是错误的,其理由是反应物中没有氢元素,不符合质量守恒定律.
【查阅资料】:1.氧化钠为白色粉末,溶于水生成氢氧化钠.:Na2O+H2O═2NaOH
2.Na2CO3溶液呈碱性.氯化钙溶液、氯化钠溶液显中性
【实验探究】甲同学对白色物质进行实验探究.
现提供如下试剂:氯化钙溶液、澄清石灰水、酚酞试液、氢氧化钠溶液、氯化钠溶液
【反思评价】丙同学认为方案1得到的结论不正确,理由是Na2CO3溶液显碱性也会使酚酞变红.
【得出结论】钠在二氧化碳中燃烧的化学方程式为4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$C+2Na2CO3.
通过以上探究,你还能得到哪些结论燃烧不一定要有氧气参加.(写出一条即可)
【提出问题】:黑色颗粒和白色物质可能是什么呢?
【进行猜想】甲认为黑色颗粒是C,白色物质可能是Na2O或Na2CO3.
乙同学还认为白色物质是氢氧化钠.甲同学立刻认为乙同学的猜想是错误的,其理由是反应物中没有氢元素,不符合质量守恒定律.
【查阅资料】:1.氧化钠为白色粉末,溶于水生成氢氧化钠.:Na2O+H2O═2NaOH
2.Na2CO3溶液呈碱性.氯化钙溶液、氯化钠溶液显中性
【实验探究】甲同学对白色物质进行实验探究.
现提供如下试剂:氯化钙溶液、澄清石灰水、酚酞试液、氢氧化钠溶液、氯化钠溶液
| 实验操作 | 实验现象 | 结论 | |
| 方案1 | 取样品少量于试管中,加入适量水,震荡,样品全部溶于水,向其中加入无色酚酞溶液 | 溶液变成 红色 | 白色物质 为Na2O |
| 方案2 | 步骤一:取样品少量于试管中,加入适量水,震荡,样品全部溶于水,向其中加入过量的CaCl2溶液 | 有白色沉淀生成 | 白色物质 Na2CO3 |
| 步骤二:过滤,取少量滤液于试管中,滴加几滴酚酞试液 | 无色酚酞试液不变色 |
【得出结论】钠在二氧化碳中燃烧的化学方程式为4Na+3CO2$\frac{\underline{\;点燃\;}}{\;}$C+2Na2CO3.
通过以上探究,你还能得到哪些结论燃烧不一定要有氧气参加.(写出一条即可)
 某厂排放的废水中含有硫酸铜,将废水处理可得到铜和铁红(氧化铁)两种产品,过程如图所示(废水中的其他物质不参与反应):
某厂排放的废水中含有硫酸铜,将废水处理可得到铜和铁红(氧化铁)两种产品,过程如图所示(废水中的其他物质不参与反应):
