题目内容
14.尿素[CO(NH2)2]是目前含氮量最高的氮肥.工业上用液氨(NH3)和CO2为原料,在高温高压下合成,反应的化学方程式为:2NH3+CO2$\frac{\underline{\;高温\;}}{高压}$CO(NH2)2+H2O.某厂生产尿素时,二氧化碳只有55%转化为尿素.请计算:
(1)尿素中氮元素的质量分数为46.7%(结果保留一位小数).
(2)生产120t尿素,至少需要二氧化碳的质量(写出计算过程和结果).
分析 (1)根据化合物中元素的质量分数=$\frac{相对原子质量×原子个数}{相对分子质量}×$×100%,据此进行分析解答;
(2)根据反应的化学方程式和尿素的质量可以计算反应的氨气质量.
解答 解:
(1)尿素中氮元素的质量分数为$\frac{14×2}{12+16+14×2+1×4}×$100%≈46.7%.
(2)设至少需要二氧化碳的质量为x.
2NH3+CO2$\frac{\underline{\;高温\;}}{高压}$CO(NH2)2+H2O
44 60
x 120 t
$\frac{44}{x}=\frac{60}{120t}$
x=88t
至少需要二氧化碳的质量为$\frac{88t}{55%}$=160t
答案:
(1)46.7;
(2)至少需要二氧化碳的质量为160t.
点评 本题主要考查学生运用假设法和化学方程式进行计算和推断的能力,计算时要注意规范性和准确性.

练习册系列答案
相关题目
5.工业冶炼金属铝的原理是2Al2O3=4Al+3O2↑,该反应属于( )
| A. | 置换反应 | B. | 化合反应 | C. | 分解反应 | D. | 复分解反应 |
9. 物质由元素组成,请根据H、C、O、Cl、Ca、Na、Fe七种元素回答下列问题.
物质由元素组成,请根据H、C、O、Cl、Ca、Na、Fe七种元素回答下列问题.
(1)某固体可以用于人工降雨,组成该固体的元素为C、O.
(2)A、B两种物质分别由1种或2种元素组成,进行如下实验.
①A物质的化学式为Fe.
②B中滴加稀盐酸,发生反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O.
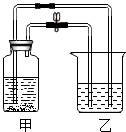
(3)如图所示,打开止水夹和胶塞,向放有少量固体C的甲中加入足量D的溶液,塞紧胶塞,观察到甲中有气泡,乙中溶液变浑浊.关闭止水夹,甲中无色液体流入乙中,乙中有气泡产生,浑浊液变为无色溶液.乙中溶液变浑浊反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O;甲中无色液体流入乙中时所含溶质可能的组成为HCl、CaCl2或HCl、NaCl.
 物质由元素组成,请根据H、C、O、Cl、Ca、Na、Fe七种元素回答下列问题.
物质由元素组成,请根据H、C、O、Cl、Ca、Na、Fe七种元素回答下列问题.(1)某固体可以用于人工降雨,组成该固体的元素为C、O.
(2)A、B两种物质分别由1种或2种元素组成,进行如下实验.
| 物质 | A | B |
| 滴加的物质 | 稀盐酸 | 稀盐酸 |
| 现象 | 生成浅绿色溶液和一种可燃性气体 | 生成黄色溶液 |
②B中滴加稀盐酸,发生反应的化学方程式为Fe2O3+6HCl=2FeCl3+3H2O.
(3)如图所示,打开止水夹和胶塞,向放有少量固体C的甲中加入足量D的溶液,塞紧胶塞,观察到甲中有气泡,乙中溶液变浑浊.关闭止水夹,甲中无色液体流入乙中,乙中有气泡产生,浑浊液变为无色溶液.乙中溶液变浑浊反应的化学方程式为Ca(OH)2+CO2=CaCO3↓+H2O;甲中无色液体流入乙中时所含溶质可能的组成为HCl、CaCl2或HCl、NaCl.
19.物质的用途与性质密切相关.下列叙述错误的是( )
| A. | 熟石灰能和酸发生反应,所以常用熟石灰改良酸性土壤 | |
| B. | 洗洁精有乳化功能,所以常用洗洁精洗涤餐具上的油污 | |
| C. | 甲醛能与蛋白质发生反应,所以甲醛可用于水产食品的保鲜 | |
| D. | 氮气化学性质不活泼,所以在食品包装中充入氮气用于防腐 |
6.2.2g某有机物在氧气中完全燃烧,生成6.6g二氧化碳和3.6g水(无其它生成物).下列对该物质组成的推断正确的是( )
| A. | 只含碳、氢元素 | B. | 含有碳、氢、氧三种元素 | ||
| C. | 含有碳、氢元素,可能含有氧元素 | D. | 碳、氢原子个数比为3:4 |
3.下列有关实验现象的描述正确的是( )
| A. | 电解水实验中,正极与负极产生气体的体积比为1:2 | |
| B. | 铁丝在氧气中燃烧,火星四射,生成红色固体 | |
| C. | 氯化铵固体和熟石灰混合研磨,生成无色、无味的气体 | |
| D. | 向氢氧化钠溶液中滴加紫色石蕊试液,溶液变红 |
15.下列仪器一般不用来做反应容器的是( )
| A. |  | B. |  | C. |  | D. |  |
