题目内容
6.过碳酸钠(2Na2CO3•3H2O2)广泛用于洗涤、纺织、医疗、造纸等.某兴趣小组展开了深入的学习:【资料卡片】:
Ⅰ、制备研究:下图是制备过碳酸钠的工艺流程.
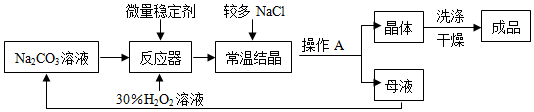
1、过碳酸钠具有碳酸钠和过氧化氢的双重性质,不稳定,受热、遇水易分解;
2、过碳酸钠分解的化学方程式为2(2Na2CO3•3H2O2)═4Na2CO3+6H2O+3O2↑
3、H2O2分解放出热量,Na2CO3受热不分解;
请回答问题:
(1)反应器中发生反应的化学方程式为2Na2CO3+3H2O2═2Na2CO3•3H2O2;
(2)生产中,反应及干燥均需在较低温度下进行,原因是防止过碳酸钠分解,影响产量和产率;
(3)生产过程中,需加入较多的NaCl,以便过碳酸钠晶体析出,这是因为过碳酸钠在NaCl溶液中溶解度较小,易析出晶体.
(4)操作A的名称是过滤,若在实验室完成此操作,需要的玻璃仪器是烧杯、玻璃棒和漏斗;
(5)洗涤过碳酸钠晶体最好选用B.
A.蒸馏水 B.无水酒精 C.饱和碳酸钠溶液 D.饱和NaCl溶液
(6)母液可以循环使用,其中主要含有的溶质是NaCl和Na2CO3(或H2O2);
Ⅱ、纯度测定:测定过碳酸钠样品(杂质不溶于水)中2Na2CO3•3H2O2的质量分数.
小组同学设计了如下图所示实验装置(部分仪器略去),并进行实验.
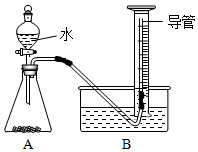
【实验步骤】:①检查气密性;②将过碳酸钠样品(2.20g)和少许黑色粉末均匀混合后置于装置A中,在量筒中加满水;③连接仪器,打开分液漏斗活塞,缓缓滴入水;④待装置A中不再产生气体时时,停止滴加水,并关闭活塞;⑤待量筒中水面不再变化时,记录其中水面刻度;⑥根据数据进行计算.
【实验分析及数据处理】:
(7)完善实验步骤的相关内容:①检查气密性、④不再产生气体时;
(8)实验中,水的作用是溶解过碳酸钠,利于其分解;黑色粉末能加快过碳酸钠的分解速率,其自身质量和化学性质在反应前后均不变,可能是MnO2(或CuO)(填化学式);
(9)实验中,A,则开始收集气体;
A.刚开始出现气泡时 B.当气泡均匀连续出现时
C.若用带火星木条放在导管口部,复燃时
(10)若量筒中收集到气体的体积是224mL(通常情况下,氧气的密度近似为1.43g•L-1.),计算过碳酸钠样品中2Na2CO3•3H2O2的质量分数[3分,Mr(2Na2CO3•3H2O2)=314、Mr(O2)=32]95.2%;
【实验反思】:
(11)经过讨论,小组同学一致认为测定结果偏大,可能原因是滴入的水占据了锥形瓶内的体积,使得O2体积偏大;
(12)量筒中长导管的作用是防止因为氧气溶于水而导致结果产生偏差;
(13)有同学提出,装置中原有空气会使测定结果偏大.这种说法是否正确,如不正确,请说明理由.不正确,装置中原有空气和生成的O2等体积代换;
(14)经过讨论,小组同学一致认为可用下述方案进行测定.方案:将装置A中剩余物过滤,洗涤滤渣,并将洗涤液并入滤液蒸发得无水固体1.39g.则样品中2Na2CO3•3H2O2的质量分数为93.6%(或93.5%).
(15)根据资料卡片,你还能设计出什么方案测定样品中2Na2CO3•3H2O2的质量分数?想方法测出过碳酸钠和酸反应生成CO2的体积或质量,进而进行计算(或过碳酸钠和氯化钙、氯化钡等溶液生成沉淀质量进行测定).(只需给出简要的方案)
分析 根据给出的转化关系对应的过程分析每个对应的问题,或者直接分析每个问题,从给出的信息中找对应的信息.
解答 解:
(1)反应器中,是碳酸钠和过氧化氢反应生成2Na2CO3•3H2O2,对应的化学方程式为 2Na2CO3+3H2O2═2Na2CO3•3H2O2;
(2)由于“过碳酸钠具有碳酸钠和过氧化氢的双重性质,不稳定,受热、遇水易分解”,所以生产中,反应及干燥均需在较低温度下进行,主要防止过碳酸钠分解,影响产量和产率;
(3)生产过程中,需加入较多的NaCl,以便过碳酸钠晶体析出,说明过碳酸钠在NaCl溶液中溶解度较小,易析出晶体.
(4)操作A是固体和液体分离,为过滤,若在实验室完成此操作,需要的玻璃仪器是烧杯、玻璃棒和漏斗;
(5)由于“过碳酸钠具有碳酸钠和过氧化氢的双重性质,不稳定,受热、遇水易分解”,所以洗涤过碳酸钠晶体不能使用含水物质,所以在给出的选项中可以选用无水酒精,从而防止过碳酸钠分解.
(6)由于加入了过量的氯化钠,同时还有剩余的碳酸钠或者过氧化氢,所以母液含有的溶质是 NaCl和Na2CO3(或H2O2);
(7)由于需要测量气体的体积,所以需要装置气密性良好,所以①检查气密性,而过程中只要待完全反应才结束实验,所以④为不再产生气体时;
(8)由于过碳酸钠具有碳酸钠和过氧化氢的双重性质,不稳定,受热、遇水易分解,所以实验中,由于水的作用是解过碳酸钠,利于其分解;黑色粉末能加快过碳酸钠的分解速率,其自身质量和化学性质在反应前后均不变,由于“过碳酸钠具有碳酸钠和过氧化氢的双重性质,不稳定,受热、遇水易分解”,所以可以根据过氧化氢分解所用的催化剂为二氧化锰或者氧化铜等黑色物质进行选择,故可能是 MnO2(或CuO)(填化学式);
(9)由于需要收集全部的生成的气体,实验中,刚开始出现气泡时,则开始收集气体,而不是强调收集的气体的纯度;
(10)设过碳酸钠的质量为x
氧气质量为224mL×10-3×1.43g•L-1=0.32g
2(2Na2CO3•3H2O2)~3O2↑
314×2 32×3
x 0.32g
$\frac{314×2}{32×3}$=$\frac{x}{0.32g}$
解得x=2.09g
则样品中,2Na2CO3•3H2O2的质量分数为:$\frac{2.09g}{2.20g}$×100%=95.0%
(11)经过讨论,小组同学一致认为测定结果偏大,可能原因是 滴入的水占据了锥形瓶内的体积,使得O2体积偏大;
(12)由于氧气能溶于水,长导管的存在导致生成的气体可以不经过水,从而减少了损耗,所以量筒中长导管的作用是防止因为氧气溶于水而导致结果产生偏差;
(13)有同学提出,装置中原有空气会使测定结果偏大.这种说法不正确,原因是装置中原有空气和生成的O2等体积代换;
(14)无水固体1.39g,该无色固体为碳酸钠.
设过碳酸钠的质量为y
2(2Na2CO3•3H2O2)═4Na2CO3+6H2O+3O2↑
314×2 106×4
y 1.39g
$\frac{314×2}{106×4}$=$\frac{y}{1.39g}$
y≈2.059g
则样品中2Na2CO3•3H2O2的质量分数为$\frac{2.059g}{2.20g}$×100%≈93.6%(或93.5%).
(15)由于过碳酸钠分解的化学方程式为2(2Na2CO3•3H2O2)═4Na2CO3+6H2O+3O2↑,所以可以考虑通过碳酸钠和酸的反应转化为气体或者和可溶性钡盐或者钙盐反应得到沉淀来实现测定,所以想方法测出过碳酸钠和酸反应生成CO2的体积或质量,进而进行计算(或过碳酸钠和氯化钙、氯化钡等溶液生成沉淀质量进行测定).(只需给出简要的方案)
故答案为:
(1)2Na2CO3+3H2O2═2Na2CO3•3H2O2;
(2)防止过碳酸钠分解,影响产量和产率;
(3)过碳酸钠在NaCl溶液中溶解度较小,易析出晶体;
(4)过滤; 玻璃棒; 漏斗;
(5)B;
(6)NaCl; Na2CO3(或H2O2);
(7)检查气密性; 不再产生气体时;
(8)溶解过碳酸钠,利于其分解; MnO2(或CuO);
(9)A;
(10)95.0%
(11)滴入的水占据了锥形瓶内的体积,使得O2体积偏大;
(12)防止因为氧气溶于水而导致结果产生偏差;
(13)不正确,装置中原有空气和生成的O2等体积代换;
(14)93.6%(或93.5%);
(15)想方法测出过碳酸钠和酸反应生成CO2的体积或质量,进而进行计算(或过碳酸钠和氯化钙、氯化钡等溶液生成沉淀质量进行测定)(其他合理答案也可得分),
点评 读图,从中获得解答题目所需的信息,所以在解答题目时先看解答的问题,然后带着问题去读给出的图进而去寻找解答有用的信息,这样提高了信息扑捉的有效性.解答的问题实际上与复杂的转化图相比,其实很简单很基础,或者可以说转化图提供的是情境,考查基本知识.

 暑假作业北京艺术与科学电子出版社系列答案
暑假作业北京艺术与科学电子出版社系列答案 第三学期赢在暑假系列答案
第三学期赢在暑假系列答案| 选项 | 物 质 | 杂 质 | 除杂试剂及操作方法 |
| A | 二氧化碳 | 一氧化碳 | 通入氧气,点燃 |
| B | 氢气 | 氯化氢 | 先通过过量氢氧化钠溶液,再通过浓硫酸 |
| C | 锌粉 | 铁粉 | 加入适量氯化锌溶液,充分反应后过滤 |
| D | 氯化钾溶液 | 碳酸钾 | 加入过量氯化钙溶液,充分反应后过滤 |
| A. | A | B. | B | C. | C | D. | D |
| 甲 | 乙 | 丙 |
| Ba(OH)2、NaOH | NaCl、Na2CO3 | HCl、NaCl |
(1)方案一,甲车间废液中加入适量的Na2CO3 溶液,可分离回收Ba(OH )2 和 NaOH,写出该反应的化学方程式Na2CO3+Ba(OH)2═BaCO3↓+2NaOH;
(2)方案二,乙、丙两车间的废液按适当比例混合后,可得到一种溶质为氯化钠的中性溶液;
(3)方案三,将三个车间的废液样品混合,过滤.得到无色溶液和白色沉淀.无色溶液中一定含有NaCl,为确定可能含有的溶质,设计下列实验,其中能达到目的是A
A. 若只加入MgSO4 溶液,能观察到明显现象
B. 若加入过量的Na2CO3 溶液后,再滴加石蕊溶液,都能观察到明显现象
C. 若加入过量的中性BaCl2 溶液后,再滴加酚酞溶液,都能观察到明显现象
(4)方案四,按照下列方式将三个车间的废液按适当比例混合(假设能反应的物质均恰好完全反应,且中间过程未过滤),最终只生成BaCO3 沉淀和NaCl 溶液的是B
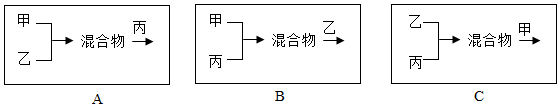 .
. | A. | 氢氧化钠、苛性钠 | B. | 氯化钠、盐 | C. | 碳酸钠、纯碱 | D. | 碳酸氢钠、小苏打 |
| A. | 一种化合物 | B. | 一种高效清洁能源 | ||
| C. | 一种可再生能源 | D. | 一种可以燃烧的固态水 |
| A. | 保险丝 | B. | 铁锅 | C. | 铜导线 | D. | 铝合金门窗 |
 根据所学知识,完成下列填空:
根据所学知识,完成下列填空: