题目内容
某化学实验室产生的废液中含有Fe3+、Cu2+、Ca2+、Cl-四种离子,为了处理废液,回收金属并制备氯化铁晶体,现设计如图实验过程(部分):
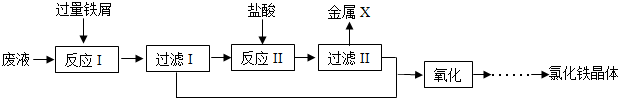
(1)金属X的化学式为 .实验室进行过滤操作除需要用到烧杯、玻璃棒和铁架台(带铁圈)外,还需要的实验用品是 .
(2)已知“反应Ⅰ”中,2FeCl3+Fe═3FeCl2,发生的另一反应化学方程式为 ;“反应Ⅱ”的化学方程式为 .
(3)“氧化”中,化合价发生变化的金属元素是 .

(1)金属X的化学式为
(2)已知“反应Ⅰ”中,2FeCl3+Fe═3FeCl2,发生的另一反应化学方程式为
(3)“氧化”中,化合价发生变化的金属元素是
考点:金属的化学性质,过滤的原理、方法及其应用,书写化学方程式、文字表达式、电离方程式
专题:金属与金属材料
分析:(1)根据金属的活动性以及过滤操作所需仪器分析;
(2)根据“反应Ⅰ”为氯化铁和氯化铜与铁反应;“反应Ⅱ”为盐酸与铁反应分析;
(3)过滤Ⅰ与过滤Ⅱ得到的滤液均为氯化亚铁溶液,氧化后生成氯化铁,铁由+2价变为+3价.
(2)根据“反应Ⅰ”为氯化铁和氯化铜与铁反应;“反应Ⅱ”为盐酸与铁反应分析;
(3)过滤Ⅰ与过滤Ⅱ得到的滤液均为氯化亚铁溶液,氧化后生成氯化铁,铁由+2价变为+3价.
解答:解:(1)铁的活动性比铜强,加入过量的铁粉,得到的金属为铁和铜,故过滤Ⅰ得到的金属为铁和铜,加入盐酸后,铁与盐酸反应,因此过滤Ⅱ得到的金属为铜;实验室进行过滤操作除需要用到烧杯、玻璃棒和铁架台(带铁圈)外,还需要的实验用品是漏斗和滤纸;
(2)废液中含有氯化铁与氯化铜,均与铁反应,故“反应Ⅰ”中反应有:2FeCl3+Fe═3FeCl2、CuCl2+Fe=FeCl2+Cu;“反应Ⅱ”为盐酸与铁反应,化学方程式为:Fe+2HCl=FeCl2+H2↑;
(3)过滤Ⅰ与过滤Ⅱ得到的滤液均为氯化亚铁溶液,氧化后生成氯化铁,铁由+2价变为+3价.
故答案为:(1)Cu; 漏斗和滤纸;
(2)CuCl2+Fe=FeCl2+Cu; Fe+2HCl=FeCl2+H2↑;
(3)铁.
(2)废液中含有氯化铁与氯化铜,均与铁反应,故“反应Ⅰ”中反应有:2FeCl3+Fe═3FeCl2、CuCl2+Fe=FeCl2+Cu;“反应Ⅱ”为盐酸与铁反应,化学方程式为:Fe+2HCl=FeCl2+H2↑;
(3)过滤Ⅰ与过滤Ⅱ得到的滤液均为氯化亚铁溶液,氧化后生成氯化铁,铁由+2价变为+3价.
故答案为:(1)Cu; 漏斗和滤纸;
(2)CuCl2+Fe=FeCl2+Cu; Fe+2HCl=FeCl2+H2↑;
(3)铁.
点评:本题主要根据金属活动性顺序以及金属的化学性质来解决问题,难度较大,须认真分析.

练习册系列答案
相关题目
下列变化中,属于化学变化的是( )
| A、酒精燃烧 | B、滴水成冰 |
| C、玻璃破碎 | D、西瓜榨汁 |
 为验证二氧化碳和氢氧化钠溶液确实能发生化学反应,两个化学兴趣小组的同学进行了如下探究活动.
为验证二氧化碳和氢氧化钠溶液确实能发生化学反应,两个化学兴趣小组的同学进行了如下探究活动. “侯氏制碱法”制得的纯碱(Na2CO3)中常含有少量氯化钠.某化学兴趣小组的同学拟测定某纯碱样品中Na2CO3的质量分数.
“侯氏制碱法”制得的纯碱(Na2CO3)中常含有少量氯化钠.某化学兴趣小组的同学拟测定某纯碱样品中Na2CO3的质量分数.
 化学就在我们身边,人类的衣、食、住、行都离不开化学.
化学就在我们身边,人类的衣、食、住、行都离不开化学.
