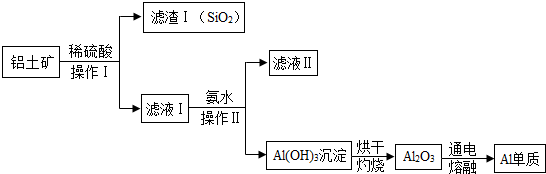
题目内容
12.如图所示为实验室中常见的气体制备、干燥、收集和性质实验的部分仪器.试根据题目要求,回答下列问题: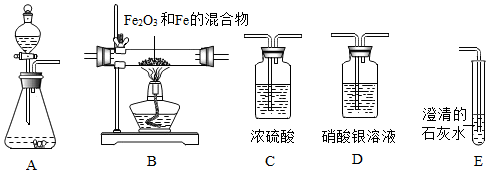
(1)若用稀盐酸和石灰石在实验室中制取二氧化碳,所得气体中混有少量氯化氢和水蒸气.
①若要制取纯净干燥的二氧化碳,并验证该气体是二氧化碳,所选仪器的连接顺序为ADCE(填写仪器序号字母)
②仪器A中发生反应的化学方程式为CaCO3+2HCl=CaCl2+H2O+CO2↑.
③仪器E中的现象为澄清的石灰水变浑浊.
(2)若用锌和稀硫酸反应制取干燥的氢气,并用来测定Fe2O3和Fe的混合物中单质铁的含量,所选仪器的连接顺序为:A→C1→B→C2→C3.(提示:Fe2O3+3H2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3H2O;C1、C2、C3为3个盛有浓硫酸的洗气瓶).
①生成氢气时发生反应的化学方程式是Zn+H2SO4═ZnSO4+H2↑.
②仪器C1的作用是除去氢气中的水蒸气.
③若B中放入Fe2O3和Fe的混合物质量为10克,完全反应后,测得剩余固体的质量为m克,则Fe2O3和Fe的混合物中铁的质量分数为($\frac{1}{3}m-\frac{7}{10}$)×100%(用m表示).
④若不连接C1,则按照③方法计算出的结果和实际值相比将基本一致(填“偏大”、“偏小”或“基本一致”)
分析 (1)①根据二氧化碳的性质可以知道干燥可以用浓硫酸,而吸收氯化氢气体可以用硝酸银溶液,验证用澄清的石灰水,可以据此来解答该题;
②根据反应的原理以及化学方程式的写法来分析;
③根据二氧化碳的性质来分析;
(2)①通常情况下,锌和稀硫酸反应生成硫酸锌和氢气;
②浓硫酸可以用来干燥氢气;
③根据化学方程式进行计算即可;
④根据测定的方法来分析.
解答 解:(1)①用稀盐酸和石灰石在实验室中制取二氧化碳属于固液常温型,所以选择装置A来制取,为了得到干燥的二氧化碳应该先用硝酸银溶液来吸收氯化氢,然后再用浓硫酸来干燥,最后通入澄清的石灰水,通过观察是否变浑浊来进行检验,因此仪器的连接顺序为:ADCE;故填:ADCE;
②石灰石的主要成分是碳酸钙,与稀盐酸反应生成氯化钙、水和二氧化碳;故填:CaCO3+2HCl=CaCl2+H2O+CO2↑;
③二氧化碳与氢氧化钙反应生成碳酸钙沉淀和水,所以观察到澄清的石灰水变浑浊;故填:澄清的石灰水变浑浊;
(2)①锌与稀硫酸反应生成硫酸锌和氢气,反应的化学反应方程式是:Zn+H2SO4═ZnSO4+H2↑;故填:Zn+H2SO4═ZnSO4+H2↑;
②仪器C1的作用是除去氢气中的水蒸气.故填:除去氢气中的水蒸气;
③设Fe2O3和Fe的混合物中铁的质量为x,则
Fe2O3+3H2$\frac{\underline{\;\;△\;\;}}{\;}$2Fe+3H2O 固体减少
160 112 160-112=48
10g-x 10g-m
$\frac{160}{48}=\frac{10g-x}{10g-m}$
x=($\frac{10}{3}$m-7)g
则Fe2O3和Fe的混合物中铁的质量分数为$\frac{(\frac{10}{3}m-7)g}{10g}×100%$=($\frac{1}{3}m-\frac{7}{10}$)×100%;故填:($\frac{1}{3}m-\frac{7}{10}$);
④此测定方法是根据装置B中固体减少的量来计算,若没有对氢气进行干燥对实验几乎没有影响;故填:基本一致.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

| A. | 该反应涉及的物质都是由原子构成的 | |
| B. | FeCl3中铁元素、氯元素的质量比为1:3 | |
| C. | X的化学式为FeCl2 | |
| D. | Fe中铁元素的化合价为+3 |
 某溶液中含有Cu(NO3)2和AgNO3,现向其中逐渐加入一定质量的铁粉进行处理,并绘制参加反应的铁的质量与溶液中溶质种类的关系图.下列说法不正确的是( )
某溶液中含有Cu(NO3)2和AgNO3,现向其中逐渐加入一定质量的铁粉进行处理,并绘制参加反应的铁的质量与溶液中溶质种类的关系图.下列说法不正确的是( )| A. | a点溶液中溶质为3种时,金属单质的种类也为1种 | |
| B. | 当溶质种类为2种时,金属单质种类可能为2种 | |
| C. | a、b两点,溶液的质量相等 | |
| D. | 当溶质种类为1种时,金属单质种类可能为3种 |





 近年来,我国的高铁建设得到了飞速发展,从整车进口到技术引进,再到自主生产,动车组列车已经完全国产化,并且引领国际潮流,“高铁外交”作为国家新名片,开启中国外交的3.0时代.高铁铁轨采用长距离无缝钢轨,用得较多的是高碳微锰钢.请回答:
近年来,我国的高铁建设得到了飞速发展,从整车进口到技术引进,再到自主生产,动车组列车已经完全国产化,并且引领国际潮流,“高铁外交”作为国家新名片,开启中国外交的3.0时代.高铁铁轨采用长距离无缝钢轨,用得较多的是高碳微锰钢.请回答: 某化学兴趣小组为了探究实验中敞口放置的氢氧化钠固体是否变质,进行了有关实验,如图所示.请你与他们一起完成以下探究活动:
某化学兴趣小组为了探究实验中敞口放置的氢氧化钠固体是否变质,进行了有关实验,如图所示.请你与他们一起完成以下探究活动: