题目内容
2.工业上用铝土矿(含有Al2O3和SiO2,不考虑其他杂质)制取金属铝的基本流程如图所示: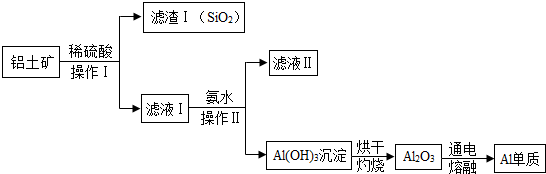
查阅资料:SiO2是一种难溶于水,也不与盐酸、硫酸反应的物质.
(1)铝土矿在与稀硫酸反应之前要充分粉碎,其目的是增大反应物的接触面积,加快反应速率.
(2)操作Ⅰ的名称是过滤.若实验室进行此操作需要的玻璃仪器有漏斗、玻璃棒、烧杯,其中玻璃棒的作用是引流.
(3)电解熔融Al2O3,除得到金属铝外,还可以得到一种常见的气体,请写出反应的化学方程式2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑,该反应的类型为分解反应.
分析 (1)根据加快反应速率的方法来分析;
(2)根据分离混合物的方法以及过滤所需仪器来分析;
(3)在通电的条件下,氧化铝分解为铝和氧气.
解答 解:(1)将铝土矿充分粉碎,增大了反应物之间的接触面积,是反应进行的速率更快、更充分;故填:增大反应物的接触面积,加快反应速率;
(2)操作Ⅰ是分离固液混合物的方法,所以是过滤,过滤操作需要的玻璃仪器主要有烧杯、漏斗、玻璃棒,玻璃棒的作用是引流;故填:过滤;漏斗;引流;
(3)在通电的条件下,氧化铝分解为铝和氧气,该反应符合“一变多”的特征,属于分解反应;故填:2Al2O3$\frac{\underline{\;通电\;}}{\;}$4Al+3O2↑;分解.
点评 本题考查了化学方程式的书写、分离混合物的方法以及基本反应类型的判断,难度不大.

练习册系列答案
相关题目
10.由SO2、SO3组成的混合气体,经分析混合气体中硫元素的质量分数为48%,则混合气体中SO2、SO3的质量比为( )
| A. | 6:5 | B. | 4:1 | C. | 4:5 | D. | 5:1 |
17. 近日,美国“信使”号水星探测器发现水星北极地区贮存着数十亿吨水冰(水为低温下固结的冰称为水冰),为人类探索水星提供了宝贵的科学资料,下列关于水冰的说法中正确的是( )
近日,美国“信使”号水星探测器发现水星北极地区贮存着数十亿吨水冰(水为低温下固结的冰称为水冰),为人类探索水星提供了宝贵的科学资料,下列关于水冰的说法中正确的是( )
 近日,美国“信使”号水星探测器发现水星北极地区贮存着数十亿吨水冰(水为低温下固结的冰称为水冰),为人类探索水星提供了宝贵的科学资料,下列关于水冰的说法中正确的是( )
近日,美国“信使”号水星探测器发现水星北极地区贮存着数十亿吨水冰(水为低温下固结的冰称为水冰),为人类探索水星提供了宝贵的科学资料,下列关于水冰的说法中正确的是( )| A. | 水冰与水的化学性质不同 | B. | 构成水冰的分子不再运动 | ||
| C. | 氢、氧两种原子的个数比为2:1 | D. | 水冰和干冰是同一种物质 |
7.在实验室进行粗盐提纯的溶解、过滤和蒸发三个操作步骤中,都要用到玻璃棒,而使用玻璃棒的目的与下列叙述无关的是( )
| A. | 加速溶解 | B. | 引流 | C. | 加快蒸发 | D. | 防止液体溅出 |
14.镧(La)是一种活动性比锌更强的元素.它的氧化物的化学式为La2O3.La(OH)3是不溶于水的碱,而LaCl3、La(NO3)3都可溶于水,由此判断下列几组物质,不能直接反应制取LaCl3的是( )
| A. | KCl和La(OH)3 | B. | La2O3和HCl | C. | La和HCl | D. | La(OH)3和HCl |
 测定某石灰石样品中碳酸钙的质量分数,其方法是:将样品与稀盐酸反应,测定反应后生产CO2的体积,再根据体积换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量.下图(1)为大理石与稀盐酸反应的反应装置,图(2)用于测量CO2的体积,下列有关说法中不正确的是( )
测定某石灰石样品中碳酸钙的质量分数,其方法是:将样品与稀盐酸反应,测定反应后生产CO2的体积,再根据体积换算为质量,最后根据CO2的质量求出样品中碳酸钙的质量.下图(1)为大理石与稀盐酸反应的反应装置,图(2)用于测量CO2的体积,下列有关说法中不正确的是( )