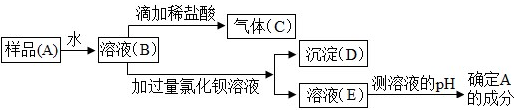
题目内容
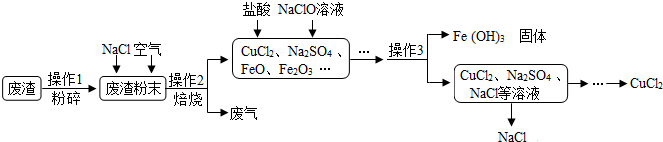
8.FeSO4•7H2O是一种重要的补铁剂.某工业废渣主要成分是Fe2O3,还含有CaCO3和SiO2(SiO2既不溶于水也不溶于稀硫酸),实验室用此废渣制备FeSO4•7H2O的流程如下,请根据流程回答问题:
(1)加入的稀硫酸与粉末中的氧化铁反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,理论上为防止稀硫酸过量当溶液中不再产生气泡时即可停止向粉末中加入稀硫酸;
(2)经测定,滤渣中只含有CaSO4和SiO2,可推知实验室能(填”能”或者”不能”)用大理石粉末与稀硫酸反应制取二氧化碳;
(3)操作②所需要的玻璃仪器有烧杯、漏斗和玻璃棒,所缺少玻璃仪器的作用是引流;
(4)操作③中发生的反应除了置换反应外,还发生了其他反应,作出判断的依据是产物只有FeSO4一种或Fe2(SO4)3变成了FeSO4;
(5)已知硫酸亚铁的溶解度和析出晶体的组成如表:
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | |
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||
分析 (1)稀硫酸和氧化铁反应生成硫酸铁和水;粉末中的碳酸钙能与硫酸反应生成二氧化碳气体;
(2)粉末状的石灰石与稀硫酸反应生成硫酸钙、水和二氧化碳;
(3)操作②是过滤,过滤所需要的玻璃仪器是烧杯、玻璃棒和漏斗;
(4)根据铁和硫酸反应生成硫酸亚铁和氢气,铁和硫酸铁反应生成硫酸亚铁进行分析;
(5)根据表中的数据可知,64℃硫酸亚铁的溶解度最大进行分析;从硫酸亚铁的溶解度曲线如图1可以看出:硫酸亚铁的溶解度随温度的升高而增大,冰水的温度低,硫酸亚铁在低温下的溶解度小,可降低洗涤过程中绿矾的溶解而造成的损失去分析解答.
解答 解:(1)稀硫酸和氧化铁反应的化学方程式为:3H2SO4+Fe2O3=Fe2(SO4)3+3H2O;粉末中的碳酸钙能与硫酸反应生成二氧化碳气体,所以当不再产生气泡就说明粉末已完全参与反应;故填:Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,不再产生气泡;
(2)因为粉末状的石灰石与稀硫酸反应能够持续产生二氧化碳,因此实验室可以用粉末状的石灰石与稀硫酸反应制二氧化碳.故填:能.
(3)操作②所需要的玻璃仪器是:烧杯、玻璃棒和漏斗.玻璃棒在过滤的操作中所起的作用是引流;故填:故填:玻璃棒,引流.
(4)因为产物只有FeSO4一种或Fe2(SO4)3变成了FeSO4,所以其中发生了铁和硫酸反应生成硫酸亚铁和氢气,铁和硫酸铁反应生成硫酸亚铁,化学方程式为:Fe+H2SO4=FeSO4+H2↑,Fe+Fe2(SO4)3=3FeSO4;故填:产物只有FeSO4一种或Fe2(SO4)3变成了FeSO4.
(5)由表中的数据可知,64℃硫酸亚铁的溶解度最大;硫酸亚铁的溶解度曲线如图1可以看出:硫酸亚铁的溶解度随温度的升高而增大,用冰水洗涤的目的是一、除去晶体表面附着的溶于水杂质,二、冰水的温度低,硫酸亚铁在低温下的溶解度小,可降低洗涤过程中绿矾的溶解而造成的损失.
故填:64;洗去FeSO4晶体表面的杂质.
点评 合理设计实验,科学地进行实验、分析实验,是得出正确实验结论的前提,因此要学会设计实验、进行实验、分析实验,为学好化学知识奠定基础.

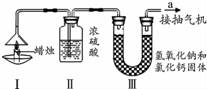 为了测定蜡烛中碳、氢两种元素的质量比,某化学兴趣小组设计了如下图所示的实验.实验步骤如下:先分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量.按图示连接好仪器装置,点燃蜡烛,同时从a导管抽气.一段时间后熄灭蜡烛,再分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量.(提示:浓硫酸只吸收水,氢氧化钠和氯化钙固体即可以吸收水分也可以吸收二氧化碳)实验数据如表.
为了测定蜡烛中碳、氢两种元素的质量比,某化学兴趣小组设计了如下图所示的实验.实验步骤如下:先分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量.按图示连接好仪器装置,点燃蜡烛,同时从a导管抽气.一段时间后熄灭蜡烛,再分别称量装置Ⅰ中蜡烛、装置Ⅱ、装置Ⅲ的质量.(提示:浓硫酸只吸收水,氢氧化钠和氯化钙固体即可以吸收水分也可以吸收二氧化碳)实验数据如表.| 蜡烛 | 装置Ⅱ | 装置Ⅲ | |
| 反应前的质量/g | 15.8 | 182.3 | 212.2 |
| 反应后的质量/g | 14.4 | 184.1 | 216. |
(2)由该实验数据计算,蜡烛中碳、氢元素的质量之比为6:1
(3)理论上,装置Ⅱ和装置Ⅲ增加的总质量大于蜡烛失去的质量,其原因是蜡烛燃烧时,氧气也参与反应,故理论上,装置II和III增加的质量等于消耗的蜡烛和氧气的总质量.
(4)该实验能否准确测出蜡烛燃烧生成二氧化碳和水的质量?不能(填“能”或“不能”),理由是空气中的水和二氧化碳也能被装置Ⅱ、装置Ⅲ吸收.
| A. | 用过滤的方法可以使硬水软化 | |
| B. | 用活性炭吸附水中的色素和异味是化学变化 | |
| C. | 水通电分解时产生的氢气和氧气质量比为2:1 | |
| D. | 可用肥皂水区分硬水与软水 |
| A. | 盐酸挥发 | B. | 铜丝导电 | C. | 蔗糖溶解 | D. | 塑料老化 |
| 选项 | 物质 | 杂质 | 除杂质的方法 |
| A | 铁 | 铜 | 适量稀硫酸、过滤 |
| B | CaCl2溶液 | 稀盐酸 | 过量CaCO3、过滤 |
| C | ZnCl2溶液 | CuCl2 | 过量锌粉、过滤 |
| D | 氯化钠固体 | 泥沙 | 加水溶解、过滤、蒸发结晶 |
| A. | A | B. | B | C. | C | D. | D |
| A. |  集气瓶 | B. |  坩埚钳 | C. |  塑料药匙 | D. |  石棉网 |
| A. | 酸碱发生中和反应生成盐和水,所以生成盐和水的反应一定是中和反应 | |
| B. | 碱中都含有氢氧根,所以碱中一定含有氢元素 | |
| C. | 酸能使紫色石蕊溶液变红,CO2通入紫色石蕊后溶液变红,所以CO2是酸 | |
| D. | 有机物都含碳元素,所以含碳元素的化合物都是有机物 |