题目内容
14.钠的化合物在日常生活中应用广泛.(1)氯化钠是重要的调味品,它是由Cl?和Na+构成的.氯化钠可以由钠在氯气中燃烧得到,反应的化学方程式为2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl.
(2)为了检验实验室保存的 NaOH 是否变质及变质情况,某同学设计了如下实验方案进行研究,请据图回答:
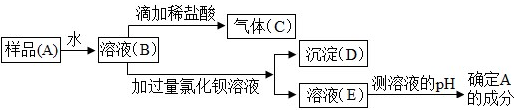
①氢氧化钠变质的原因是CO2+2NaOH=Na2CO3+H2O(用化学方程式表示),根据实验现象,你认为该氢氧化钠固体已变质(填“已”或“未”).
②实验中加入过量氯化钡溶液的目的是除去溶液中的Na2CO3.
③实验中测定溶液 pH 的方法是用玻璃棒蘸取待测液,滴到放在干燥玻璃片上的pH试纸上,与标准比色卡比较,读出该溶液的pH. 若测得溶液E的pH>7,则样品A的成分是NaOH和Na2CO3.
(3)取已变质的氢氧化钠样品配制成 100g 溶液,向其中加入溶质质量分数为 7.3%的稀盐酸 100g,完全反应后得到中性溶液 197.8g.试计算所取样品中杂质的质量.
分析 (1)根据氯化钠是由钠离子、氯离子构成的,钠和氯气在点燃的条件下生成氯化钠进行分析;
(2)①根据二氧化碳和氢氧化钠反应生成碳酸钠和水,溶液中滴加稀盐酸,有气泡产生,说明氢氧化钠已经变质;
②根据氯化钡和碳酸钠反应会生成碳酸钡沉淀和氯化钠进行分析;
③根据pH试纸的正确使用方法进行分析;
(3)根据质量守恒定律计算生成二氧化碳的质量,然后依据化学方程式进行计算.
解答 解:(1)氯化钠是由钠离子、氯离子构成的,钠和氯气在点燃的条件下生成氯化钠,化学方程式为:2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl;
(2)①二氧化碳和氢氧化钠反应生成碳酸钠和水,化学方程式为:CO2+2NaOH=Na2CO3+H2O,溶液中滴加稀盐酸,有气泡产生,说明氢氧化钠已经变质;
②氯化钡和碳酸钠反应会生成碳酸钡沉淀和氯化钠,所以实验中加入过量氯化钡溶液的目的是除去溶液中的Na2CO3;
③实验中测定溶液pH的方法是:用玻璃棒蘸取待测液,滴到放在干燥玻璃片上的pH试纸上,与标准比色卡比较,读出该溶液的pH,若测得溶液E的pH>7,则样品A的成分是NaOH 和 Na2CO3;
(3)生成二氧化碳的质量为:100g+100g-197.8g=2.2g,
设参加反应的碳酸钠质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 2.2g
$\frac{106}{x}$=$\frac{44}{2.2g}$
x=5.3g
故答案为:(1)Cl?和 Na+,2Na+Cl2$\frac{\underline{\;点燃\;}}{\;}$2NaCl;
(2)①CO2+2NaOH=Na2CO3+H2O,已;
②除去溶液中的Na2CO3;
③用玻璃棒蘸取待测液,滴到放在干燥玻璃片上的pH试纸上,与标准比色卡比较,读出该溶液的pH;NaOH 和 Na2CO3;
(3)5.3g.
点评 在解此类题时,首先分析题中考查的问题,然后结合学过的知识和题中的提示进行解答.

2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+O2↑+4X↑,推测X的化学式( )
| A. | N2O | B. | NO2 | C. | N2O | D. | N2O5 |
| A. | 奶类、虾皮、豆类中含有丰富的人体所需的钙元素 | |
| B. | 铁、碘、氟、钠、硒是人体所需的微量元素 | |
| C. | 除水外,我们每天需要量最大的营养素是糖类 | |
| D. | 人体内碘元素缺乏或过量都会引起甲状腺肿大 |
| 选项 | 物质 | 杂质 | 除杂方法 |
| A | CO2 | CO | 点燃 |
| B | NaOH溶液 | Na2CO3溶液 | 加入适量稀盐酸 |
| C | 铜粉 | 铁粉 | 加入过量的稀硫酸,过滤 |
| D | CaO | CaCO3 | 加水,溶解、过滤 |
| A. | A | B. | B | C. | C | D. | D |

(1)加入的稀硫酸与粉末中的氧化铁反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,理论上为防止稀硫酸过量当溶液中不再产生气泡时即可停止向粉末中加入稀硫酸;
(2)经测定,滤渣中只含有CaSO4和SiO2,可推知实验室能(填”能”或者”不能”)用大理石粉末与稀硫酸反应制取二氧化碳;
(3)操作②所需要的玻璃仪器有烧杯、漏斗和玻璃棒,所缺少玻璃仪器的作用是引流;
(4)操作③中发生的反应除了置换反应外,还发生了其他反应,作出判断的依据是产物只有FeSO4一种或Fe2(SO4)3变成了FeSO4;
(5)已知硫酸亚铁的溶解度和析出晶体的组成如表:
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | |
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||


 法国化学家拉瓦锡通过实验得出的结论是氧气约占空气总体积的$\frac{1}{5}$.某同学用如图装置进行验证,实验后发现气体减少的体积小于$\frac{1}{5}$,请你帮助这位同学找出两种可能造成这样结果的原因:
法国化学家拉瓦锡通过实验得出的结论是氧气约占空气总体积的$\frac{1}{5}$.某同学用如图装置进行验证,实验后发现气体减少的体积小于$\frac{1}{5}$,请你帮助这位同学找出两种可能造成这样结果的原因: