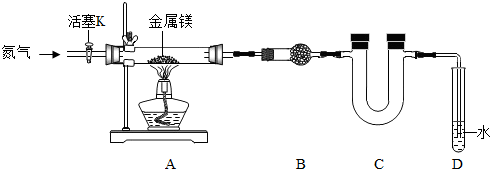
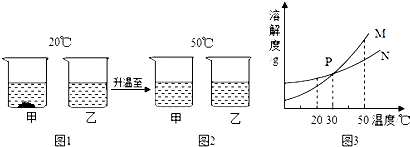
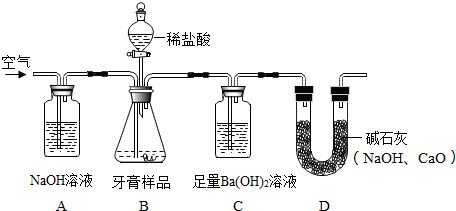
题目内容
11.水是我们日常生活必不可少的物质,下列有关水的说法正确的是( )| A. | 用过滤的方法可以使硬水软化 | |
| B. | 用活性炭吸附水中的色素和异味是化学变化 | |
| C. | 水通电分解时产生的氢气和氧气质量比为2:1 | |
| D. | 可用肥皂水区分硬水与软水 |
分析 A、根据过滤的原理分析;
B、根据变化的特征分析;
C、根据电解水实验的现象和结论分析;
D、根据区分硬水与软水的方法分析.
解答 解:A、用过滤的方法不能减少水中钙、镁离子化合物的含量,不能使硬水软化,故A错误;
B、用活性炭吸附水中的色素和异味,没有新物质生成,是物理变化,故B错误;
C、水通电分解时产生的氢气和氧气质量比为1:8,故C错误;
D、可用肥皂水区分硬水与软水,遇肥皂水产生的泡沫少的是硬水,遇肥皂水产生的泡沫多的是软水,故D正确.
故选D.
点评 正确运用化学知识解释生活现象,是本题的考查目的,体现运用化学知识解决问题的能力.

练习册系列答案
相关题目
2.某工厂生产一种焰火火药中所含的硝酸铜在燃烧时产生绿色火焰,其化学方程式为:
2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+O2↑+4X↑,推测X的化学式( )
2Cu(NO3)2$\frac{\underline{\;\;△\;\;}}{\;}$2CuO+O2↑+4X↑,推测X的化学式( )
| A. | N2O | B. | NO2 | C. | N2O | D. | N2O5 |
19.人体健康离不开化学.下列叙述错误的是( )
| A. | 奶类、虾皮、豆类中含有丰富的人体所需的钙元素 | |
| B. | 铁、碘、氟、钠、硒是人体所需的微量元素 | |
| C. | 除水外,我们每天需要量最大的营养素是糖类 | |
| D. | 人体内碘元素缺乏或过量都会引起甲状腺肿大 |
6.下列除去杂质的方法中,合理的是( )
| 选项 | 物质 | 杂质 | 除杂方法 |
| A | CO2 | CO | 点燃 |
| B | NaOH溶液 | Na2CO3溶液 | 加入适量稀盐酸 |
| C | 铜粉 | 铁粉 | 加入过量的稀硫酸,过滤 |
| D | CaO | CaCO3 | 加水,溶解、过滤 |
| A. | A | B. | B | C. | C | D. | D |
8.FeSO4•7H2O是一种重要的补铁剂.某工业废渣主要成分是Fe2O3,还含有CaCO3和SiO2(SiO2既不溶于水也不溶于稀硫酸),实验室用此废渣制备FeSO4•7H2O的流程如下,请根据流程回答问题:

(1)加入的稀硫酸与粉末中的氧化铁反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,理论上为防止稀硫酸过量当溶液中不再产生气泡时即可停止向粉末中加入稀硫酸;
(2)经测定,滤渣中只含有CaSO4和SiO2,可推知实验室能(填”能”或者”不能”)用大理石粉末与稀硫酸反应制取二氧化碳;
(3)操作②所需要的玻璃仪器有烧杯、漏斗和玻璃棒,所缺少玻璃仪器的作用是引流;
(4)操作③中发生的反应除了置换反应外,还发生了其他反应,作出判断的依据是产物只有FeSO4一种或Fe2(SO4)3变成了FeSO4;
(5)已知硫酸亚铁的溶解度和析出晶体的组成如表:
根据上表,硫酸亚铁晶体(FeSO4•7H2O)冷却结晶温度最高不超过64;待结晶完毕后,滤出晶体,用少量硫酸亚铁饱和溶液洗涤2~3次,再用滤纸将晶体吸干.用硫酸亚铁饱和溶液洗涤的目的是:①洗去FeSO4晶体表面的杂质、②减少晶体的损耗.

(1)加入的稀硫酸与粉末中的氧化铁反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O,理论上为防止稀硫酸过量当溶液中不再产生气泡时即可停止向粉末中加入稀硫酸;
(2)经测定,滤渣中只含有CaSO4和SiO2,可推知实验室能(填”能”或者”不能”)用大理石粉末与稀硫酸反应制取二氧化碳;
(3)操作②所需要的玻璃仪器有烧杯、漏斗和玻璃棒,所缺少玻璃仪器的作用是引流;
(4)操作③中发生的反应除了置换反应外,还发生了其他反应,作出判断的依据是产物只有FeSO4一种或Fe2(SO4)3变成了FeSO4;
(5)已知硫酸亚铁的溶解度和析出晶体的组成如表:
| 温度/℃ | 0 | 10 | 30 | 40 | 50 | 60 | 64 | 70 | 80 | 90 |
| 溶解度/g | 15.6 | 20.5 | 33.0 | 40.4 | 48.8 | 55.0 | 55.3 | 50.6 | 43.7 | |
| 析出晶体 | FeSO4•7H2O | FeSO4•4H2O | FeSO4•H2O | |||||||